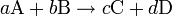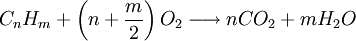- Reacción irreversible
-
Reacción irreversible
Una reacción irreversible es una reacción química que puede simbolizarse con la siguiente ecuación química:
Donde la flecha indica un único sentido para la reacción. En la reacción irreversible la reacción inversa prácticamente no ocurre y en consecuencia en el equilibrio el reactivo en defecto (el que se encuentra en menor cantidad) puede llegar a agotarse. Que un reactivo se agote significa que en el equilibrio su concentración será nula o despreciable (tenderá a cero). El valor de K[1] para una reacción "irreversible" tendrá un valor muy grande, por lo que este valor puede utilizarse como criterio para determinar si una reacción es completa o irreversible, sin embargo, cuánto significa "muy grande" dependerá de criterios prácticos definidos de acuerdo al sistema en estudio y al objetivo del mismo. Las reacciones irreversibles pueden ser vistas como un extremo, "casos especiales" de reacciones reversibles.
Las reacciones de combustión son un ejemplo de reacciones irreversibles, en las que K puede tomar valores del orden de 10100. Por ejemplo el petróleo, que podemos simbolizar con
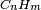 (o la madera) en presencia de oxígeno:
(o la madera) en presencia de oxígeno:se quemará para dar dióxido de carbono (
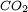 ) y agua (
) y agua (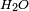 ) los cuales necesitarán de los procesos biológicos de fotosíntesis para volver a transformarse en sustancias orgánicas, ya que la reacción inversa no sucederá en forma espontánea.
) los cuales necesitarán de los procesos biológicos de fotosíntesis para volver a transformarse en sustancias orgánicas, ya que la reacción inversa no sucederá en forma espontánea.Contenido
Deducción de la constante de equilibrio
Si Ai representa cualquier reactivo o producto y ai su coeficiente estequiométrico, una reacción química cualquiera puede escribirse como:
(1)
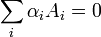
siendo ai un número positivo para un producto y negativo para un reactivo. Con esta nomenclatura, la energía libre de la reacción DGR se calcula como:
(2)
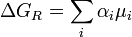
donde mi es el potencial químico de la sustancia Ai
Expresando mi en función de la actividad (ai) de la sustancia Ai en el sistema de reacción:
(3)
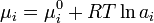
Donde moi es el potencial químico en el Estado Normal de Ai, definido para el cálculo de la actividad ai. Reemplazando la ecuación 3 en la ecuación 2 y reordenando, se obtiene:
(4)
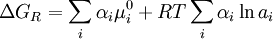
El 1er término en el 2º miembro de la anterior es la energía libre normal de reacción:
(5)
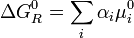
Esta propiedad de la reacción normalizada es de gran importancia para el cálculo del equilibrio como veremos a continuación. Suele llamarse estándar en lugar de normal, pero llamaremos estándar a los valores de las propiedades tabuladas en condiciones estándar, 25 ºC y 1 atm y en un estado definido de gas ideal, o líquido o sólido. El Estado Normal (EN) y el Estado Estándar (EE) se distinguirán sólo por la temperatura, la del EN es la del sistema y la del EE es 25 ºC.
La suma de los logaritmos de las actividades puede expresarse como el logaritmo de un producto:
(6)
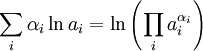
Si se define Ka, la “constante” de equilibrio químico como el valor de la productoria en el paréntesis de la ecuación anterior evaluada en el equilibrio:
(7)
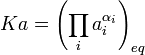
Puesto que cuando la reacción llega al equilibrio el valor de DGR se anula, de las ecuaciones 4 a 7 se deduce que:
(8)
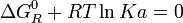
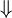
(9)
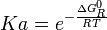
La relación entre Ka y las actividades en el equilibrio, vendrá dada por la ecuación 7. A pesar de la apariencia de dicha ecuación se deduce de la ecuación 9 que Ka no depende de la composición del sistema, pues su valor vendrá determinado por la temperatura y por las propiedades termodinámicas en el EN de los componentes de la reacción. Por esta causa se la llama “constante” de equilibrio, aunque de hecho depende de la temperatura.
Puesto que por definición G = H – TS, para las propiedades de reacción se cumple una relación similar, entonces si:
(10)
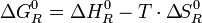
será
(11)
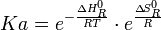
De la ecuación 11 vemos que la constante de equilibrio es el producto de dos factores, el primero de origen térmico y el segundo entrópico. Consideremos los valores de los exponentes para la reacción de combustión de un hidrocarburo normal CnHm, donde m = 2(n+1).
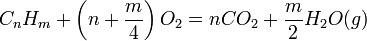
En la siguiente tabla se presentan los valores de los exponentes de la ecuación 11 para las reacciones de combustión de los tres primeros hidrocarburos: metano, etano y propano, y los valores de Ka calculados a partir de esta ecuación, evaluados a 25 ºC (con lo que coinciden en este caso el estado normal y el estándar).
Constante Ka a 25 ºC para algunas reacciones de combustión
Hidrocarburo Ka 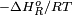
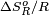
metano 2,18 × 10140 323,8 –0,625 etano 5,38 × 10252 576,3 5,631 propano 1,54 × 10363 824,2 12,098 Estado normal para todos los componentes: gas ideal puro a 25 ºC y 1 atm. De la tabla se deduce que para estas reacciones el mayor peso en el valor de Ka está dado por el efecto térmico (entalpía de la reacción), ya que el calor liberado por la reacción es el principal responsable de los enormes Ka para la combustión de los hidrocarburos.
Observaciones: se destaca que la diferencia de entropía normal de la reacción no necesariamente es positiva para una reacción irreversible (ver valores del metano), sin embargo este valor negativo es ampliamente compensado por la entalpía de la reacción. Si bien para los hidrocarburos siguientes
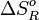 toma un valor positivo el mayor peso en el valor de Ka sigue siendo el efecto térmico.
toma un valor positivo el mayor peso en el valor de Ka sigue siendo el efecto térmico.Ka ¿es función únicamente de T o depende de T y P?
Este punto suele prestarse a confusión y la respuesta hay que buscarla en la ecuación 5 y en la ecuación 9. Puesto que la energía libre normal
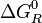 se calcula en función de los potenciales químicos
se calcula en función de los potenciales químicos 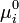 y éstos se evalúan en los EN elegidos para cada componente para el cálculo de la actividad αi (ecuación 3), de cómo se elijan los EN surgirá la dependencia de Ka. Por necesidad de la formulación teórica del concepto de actividad, la temperatura de los EN es la del sistema (T), mientras que la presión del EN (PEN) es arbitraria y puede elegirse igual a la del sistema (P) o bien igual a un valor fijo, generalmente 1 atm o 1 bar.
y éstos se evalúan en los EN elegidos para cada componente para el cálculo de la actividad αi (ecuación 3), de cómo se elijan los EN surgirá la dependencia de Ka. Por necesidad de la formulación teórica del concepto de actividad, la temperatura de los EN es la del sistema (T), mientras que la presión del EN (PEN) es arbitraria y puede elegirse igual a la del sistema (P) o bien igual a un valor fijo, generalmente 1 atm o 1 bar.Si PEN se toma igual a la del sistema P, los
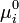 serán función de P y T
serán función de P y T ![\Rightarrow \Big [ \mu _{i}^{0}\big ( P,T \big )
\Big ]\,\!](/pictures/eswiki/98/b582746adf5e7b4aad8551ae8766b209.png) .
.Esta es la elección usual cuando el concepto de actividad αi se aplica al cálculo del equilibrio de fases. Para el cálculo del equilibrio químico en cambio, por lo general se toma para el EN una P fija e igual a la de la tabla de donde se obtengan las propiedades de formación de los componentes, necesarias para el cálculo de las propiedades de la reacción. Por esta causa – una razón práctica, no teórica – para cálculos de equilibrio químico, la constante de actividades Ka resulta una función exclusiva de la temperatura.
- ↑ Aunque K y Kα simbolizan el mismo concepto, la constante de equilibrio se indica como Kα cuando se calcula usando las actividades, que da su valor exacto.
Véase también
Categoría: Reacciones químicas
Wikimedia foundation. 2010.