- Concentración
-
En química, la concentración de una disolución es la proporción o relación que hay entre la cantidad de soluto y la cantidad de disolvente, donde el soluto es la sustancia que se disuelve, el disolvente la sustancia que disuelve al soluto, y la disolución es el resultado de la mezcla homogénea de las dos anteriores. A menor proporción de soluto disuelto en el disolvente, menos concentrada está la disolución, y a mayor proporción más concentrada ésta.
Contenido
Solubilidad
Cada sustancia tiene una solubilidad para un disolvente determinado. La solubilidad es la cantidad máxima de soluto que puede mantenerse disuelto en una disolución, y depende de condiciones como la temperatura, presión, y otras sustancias disueltas o en suspensión. Cuando se alcanza la máxima cantidad de soluto en una disolución se dice que la disolución está saturada, y ya no se admitirá más soluto disuelto en ella. Si agregamos un poco de sal común a un vaso de agua, por ejemplo, y la agitamos con una cucharita, la sal se disolverá. Si continuamos agregando sal, habrá cada vez más concentración de ésta hasta que el agua ya no pueda disolver más sal por mucho que la agitemos. Entonces, la disolución estará saturada, y la sal que le agreguemos, en vez de disolverse se precipitará al fondo del vaso. Si calentamos el agua, ésta podrá disolver más sal (aumentará la solubilidad de la sal en el agua), y si la enfriamos, el agua tendrá menos capacidad para retener disuelta la sal, y el exceso se precipitará.
Formas de expresar la concentración
Los términos cuantitativos son cuando la concentración se expresa científicamente de una manera numérica muy exacta y precisa. Algunas de estas formas cuantitativas de medir la concentración son los porcentajes del soluto (como los usados en la introducción), la molaridad, la normalidad, y partes por millón, entre otras. Estas formas cuantitativas son las usadas tanto en la industria para la elaboración de productos como también en la investigación científica.
- Ejemplos
El alcohol comercial de uso doméstico, por ejemplo, generalmente no viene en una presentación pura (100% alcohol), sino que es una disolución de alcohol en agua en cierta proporción, donde el alcohol es el soluto (la sustancia que se disuelve) y el agua es el disolvente (la sustancia que disuelve el soluto). Cuando la etiqueta del envase dice que este alcohol está al 70% V/V (de concentración) significa que hay un 70% de alcohol, y el resto, el 30%, es agua. El jugo de naranja comercial suele tener una concentración de 60% V/V, lo que indica que el 60%, (el soluto), es jugo de naranja, y el resto, el 40% (el disolvente), es agua. La tintura de iodo, que en una presentación comercial puede tener una concentración 5%, significa que hay un 5% de iodo, (el soluto), disuelto en un 95% de alcohol, (el disolvente).
Concentración en términos cualitativos
La concentración de las disoluciones en términos cualitativos, también llamados empíricos, no toma en cuenta cuantitativamente (numéricamente) la cantidad exacta de soluto y disolvente presentes, y dependiendo de su proporción la concentración se clasifica como sigue:
Diluida o concentrada
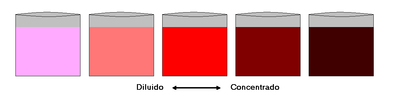
A menudo en el lenguaje informal, no técnico, la concentración se describe de una manera cualitativa, con el uso de adjetivos como "diluido" o "débil" para las disoluciones de concentración relativamente baja, y de otros como "concentrado" o "fuerte" para las disoluciones de concentración relativamente alta. En una mezcla, esos términos relacionan la cantidad de una sustancia con la intensidad observable de los efectos o propiedades, como el color, sabor, olor, viscosidad, conductividad eléctrica, etc, causados por esa sustancia. Por ejemplo, la concentración de un café puede determinarse por la intensidad de su color y sabor, la de una limonada por su sabor y olor, la del agua azucarada por su sabor. Una regla práctica es que cuanto más concentrada es una disolución cromática, generalmente más intensamente coloreada está.
Dependiendo de la proporción de soluto con respecto al disolvente, una disolución puede estar diluida o concentrada:
- Disolución diluida: Es aquella en donde la cantidad de soluto está en una pequeña proporción en un volumen determinado.
- Disolución concentrada: Es la que tiene una cantidad considerable de soluto en un volumen determinado. Las soluciones saturadas y sobresaturadas son altamente concentradas.
Insaturada, saturada y sobresaturada
La concentración de una disolución puede clasificarse, en términos de la solubilidad. Dependiendo de si el soluto está disuelto en el disolvente en la máxima cantidad posible, o menor, o mayor a esta cantidad, para una temperatura y presión dados:
- Disolución insaturada: Es la disolución que tiene una menor cantidad de soluto que el máximo que pudiera contener a una temperatura y presión determinadas.
- Disolución saturada: Es la que tiene la máxima cantidad de soluto que puede contener a una temperatura y presión determinadas. Una vez que la disolución está saturada ésta no disuelve más soluto. En ellas existe un equilibrio entre el soluto y el disolvente.
- Disolución sobresaturada: Es la que contiene un exceso de soluto a una temperatura y presión determinadas (tiene más soluto que el máximo permitido en una disolución saturada). Cuando se calienta una disolución saturada, se le puede disolver una mayor cantidad de soluto. Si esta disolución se enfría lentamente, puede mantener disuelto este soluto en exceso si no se le perturba. Sin embargo, la disolución sobresaturada es inestable, y con cualquier perturbación, como por ejemplo, un movimiento brusco, o golpes suaves en el recipiente que la contiene, el soluto en exceso inmediatamente se precipitará, quedando entonces como una solución saturada.
Concentración en términos cuantitativos
Para usos científicos o técnicos, una apreciación cualitativa de la concentración casi nunca es suficiente, por lo tanto las medidas cuantitativas son necesarias para describir la concentración.
A diferencia de las concentraciones expresadas de una manera cualitativa o empírica, las concentraciones expresadas en términos cuantitativos o valorativos toman en cuenta de una manera muy precisa las proporciones entre las cantidades de soluto y disolvente que se están utilizando en una disolución. Este tipo de clasificación de las concentraciones es muy utilizada en la industria, los procedimientos químicos, en la farmacia, la ciencia, etc, ya que en todos ellos es necesario mediciones muy precisas de las concentraciones de los productos.
Hay varias maneras de expresar la concentración cuantitativamente, basándose en la masa, el volumen, o ambos. Según cómo se exprese, puede no ser trivial convertir de una medida a la otra, pudiendo ser necesario conocer la densidad. Ocasionalmente esta información puede no estar disponible, particularmente si la temperatura varía. Por tanto, la concentración de la disolución puede expresarse como:
- Porcentaje masa-masa (% m/m)
- Porcentaje volumen-volumen (% V/V)
- Porcentaje masa-volumen (% m/V)
- Molaridad
- Molalidad
- Formalidad
- Normalidad
- Fracción molar
- En concentraciones muy pequeñas:
- Partes por millón (PPM)
- Partes por billón (PPB)
- Partes por trillón (PPT)
- Otras:
- Densidad
- Nombres propios
En el Sistema Internacional de Unidades (SI) se emplean las unidades mol·m-3.
Porcentaje masa-masa, volumen-volumen y masa-volumen
Porcentaje masa-masa (% m/m)
Se define como la masa de soluto (sustancia que se disuelve) por cada 100 unidades de masa de la disolución:

Por ejemplo, si se disuelven 20 g de azúcar en 80 g de agua, el porcentaje en masa será: [20/(80+20)]x 100=20% o, para distinguirlo de otros porcentajes, 20% m/m (en inglés, %w/w).
Porcentaje volumen-volumen (% V/V)
Expresa el volumen de soluto por cada cien unidades de volumen de la disolución. Se suele usar para mezclas líquidas o gaseosas, en las que el volumen es un parámetro importante a tener en cuenta. Es decir, el porcentaje que representa el soluto en el volumen total de la disolución. Suele expresarse simplificadamente como «% v/v».

Por ejemplo, si se tiene una solución del 20% en volumen (20% v/v) de alcohol en agua quiere decir que hay 20 mL de alcohol por cada 100 mL de disolución.
La graduación alcohólica de las bebidas se expresa precisamente así: un vino de 12 grados (12°) tiene un 12% (v/v) de alcohol.
Concentración en masa (% m/V)
Se pueden usar también las mismas unidades que para medir la densidad aunque no conviene combinar ambos conceptos. La densidad de la mezcla es la masa de la disolución dividida por el volumen de ésta, mientras que la concentración en dichas unidades es la masa de soluto dividida por el volumen de la disolución por 100. Se suelen usar gramos por mililitro (g/mL) y a veces se expresa como «% m/V».

Cálculos con porcentajes masa-masa y volumen-volumen
Para cálculos con los porcentajes masa-masa y volumen-volumen debemos manejar dos conceptos:
- La suma de la masa del soluto más la masa del disolvente es igual a la masa de la disolución
- Disolución = soluto + disolvente
- Se usa la regla de tres para calcular diferentes proporciones.
Disolución = soluto + disolvente
Cuando trabajamos con masa-masa y volumen-volumen hay una relación sencilla entre la disolución, el soluto y el disolvente, y dados dos de estos valores, se puede calcular el tercero.
La disolución es la suma del soluto más el disolvente:
Y despejando,
- soluto = Disolución - disolvente
- disolvente = Disolución - soluto
Esto es válido para cuando trabajamos con masas, o volúmenes en los casos de porcentaje masa-masa y porcentaje volumen-volumen, pero no para cuando trabajamos con porcentajes masa-volumen, puesto que el soluto y el disolvente están representados con unidades diferentes (de masa y volumen respectivamente).
soluto 20 g 5% disolvente 380 g 95% disolución 400 g 100% En la tabla se representa una disolución de 20 gramos de sal común disuelta en 380 gramos de agua, dando como resultado 400 gramos de agua salada. La concentración de la sal es del 5% de la masa, y el agua representa el 95%, dando un total del 100% para la disolución. En la tabla se representan las masas con un fondo amarillo, y los porcentajes con un fondo verde. Si tenemos un problema en el que nos den dos de las masas, podemos calcular la tercera. Ver la parte de la tabla con el fondo amarillo:
- Disolución = soluto + disolvente. Si la masa de la sal es de 20 g, y la del agua es de 380 g, la disolución tendrá una masa que es la suma de las dos anteriores, es decir, 400 g = 20 g + 380 g
- soluto = Disolución - disolvente. Si tenemos la masa de la disolución y la del disolvente, la del soluto será igual a la de la disolución menos la del disolvente: 20 g = 400 g - 380 g
- disolvente = Disolución - soluto. Si tenemos la masa de la disolución y la del soluto, la del disolvente es igual a la de la disolución menos la del soluto: 380 g = 400 g - 20 g
Con los porcentajes ocurre algo similar, excepto que es más sencillo porque el porcentaje de la disolución es siempre 100%, basta con tener el porcentaje del soluto o el del disolvente para conocer el otro. Ver la parte del cuadro de arriba con el fondo verde:
- soluto = 100 - disolvente. Si el disolvente está en un 95%, el porcentaje del soluto estará en un 5% = 100% - 95%
- disolvente = 100 - soluto. Si el soluto está al 5%, el porcentaje del disolvente estará en un 95% = 100% - 5%
Regla de tres para calcular proporciones
La regla de tres es frecuentemente usada para calcular concentraciones ya que hay una relación proporcional entre el soluto, el solvente y la disolución y entre los porcentajes de cada uno de ellos.
La regla de tres se puede dar en tres casos:
- entre el soluto y el disolvente.
- entre el soluto y la disolución.
- entre el disolvente y la disolución.
Hay que tomar en cuenta que el porcentaje de la disolución es siempre el 100%.
Abajo se presentan las tres posibilidades en que podemos usar la regla de tres para solucionar problemas de concentración. En cada caso, si se tienen tres valores podemos calcular el cuarto:
Regla de tres entre el soluto y el disolvente
soluto 20 g 5% disolvente 380 g 95% disolución 400 g 100% Ejemplo: Supongamos que no tenemos los gramos del disolvente. Para calcularlo, usamos la regla de tres: - Si 20 gramos del soluto son el 5%,y
- X gramos del disolvente son el 95%,
- ¿cuántos son los gramos del disolvente?
- Los gramos del disolvente son 380 g = 20 g x 95 / 5
Regla de tres entre el soluto y la disolución
soluto 20 g 5% disolvente 380 g 95% disolución 400 g 100% Ejemplo: Supongamos que no tenemos el porcentaje del soluto. Para calcularlo, usamos la regla de tres: - Si 20 gramos del soluto son el X%, y
- 380 gramos de disolución son el 95%,
- ¿cuánto es el porcentaje del soluto?
- El porcentaje del soluto es 5% = 20 g * 95 / 380 g
Regla de tres entre el disolvente y la disolución
soluto 20 g 5% disolvente 380 g 95% disolución 400 g 100% Ejemplo: Supongamos que no tenemos los gramos de la disolución. Para calcularlo, usamos la regla de tres: - Si 380 gramos del disolvente son el 95%, y
- X gramos de la disolución son el 100%,
- ¿cuántos son los gramos de la disolución?
- Los gramos de la disolución son 400 g = 380 g x 100 / 95
Ejemplos
Manejando las reglas de tres y la fórmula de Disolución = disolvente + soluto, se pueden resolver una gran variedad de problemas de concentración con porcentajes masa-masa y volumen-volumen.
Los procedimientos para los cálculos con porcentajes volumen-volumen son exactamente iguales a los de masa-masa, excepto que en lugar de trabajar con unidades de masa como los gramos, se usan unidades de volumen, como el cm3.
Ejemplo 1
Se tienen 250 gramos de agua y se quiere hacer una disolución de bicarbonato de sodio al 8%. ¿Cuántos gramos de bicarbonato de sodio se necesitan?, ¿cuantos gramos de disolución se producirán?, ¿cuál es el porcentaje del disolvente?
Datos:
-
soluto ?? g 8% disolvente 250 g ??% disolución ?? g 100%
Calculo el porcentaje del disolvente:- Disolución = soluto + disolvente --> Disolvente = disolución - soluto
- El porcentaje del disolvente es 92% = 100% - 8%
-
soluto ?? g 8% disolvente 250 g 92% disolución ?? g 100%
Ahora tengo los gramos del disolvente y también su concentración, sus datos están "completos" (hay una pareja "masa-porcentaje"), así que puedo usarlo como base para calcular tanto la masa del soluto como la masa de la disolución. Con la regla de tres entre el soluto y el disolvente se puede calcular la masa del soluto, y con la regla de tres entre el disolvente y la disolución se puede calcular la masa de la disolución.Usaremos la regla de tres entre el soluto y el disolvente para obtener los gramos del soluto:
- Si X gramos de soluto son el 8%, y 250 gramos de disolvente son el 92%, ¿cuantos gramos tiene el soluto?
- El soluto tiene 21,74 g = 250 g x 8 / 92
-
soluto 21,74 g 8% disolvente 250 g 92% disolución ?? g 100%
Los gramos de la disolución los podemos encontrar de tres maneras: con la regla de tres entre el soluto y la disolución, con la regla de tres entre el disolvente y la disolución, o sumando la disolución y el disolvente. Se usará esta última.Sumo el soluto y el disolvente para obtener los gramos de la disolución:
- Disolución = soluto + disolvente
- Los gramos disolución son 271,74 g = 21,74 g + 250 g
-
soluto 21,74 g 8% disolvente 250 g 92% disolución 271,74 g 100%
Ejemplo 2
Se mezclan dos disoluciones de cloruro de sodio. La primera son 120 gramos de disolución al 10%, la segunda son 240 gramos al 8%. ¿Cuál es la concentración la disolución resultante?, ¿cuántos gramos de agua y cloruro de sodio tiene?
En este ejemplo tenemos tres disoluciones. Las dos primeras son mezcladas para dar una tercera. La cantidad de agua y cloruro de sodio de la tercera es la suma del agua y del cloruro de sodio de las dos primeras (ley de conservación de la masa). Por lo tanto, debemos calcular la cantidad de estas sustancias en las dos primeras disoluciones para luego sumarlas y obtener las cantidades que conforman la tercera disolución, y por último calcular el porcentaje de concentración de la tercera.
Primera disolución Segunda disolución 120 gramos de disolución al 10%
-
soluto ?? g 10% disolvente ?? g disolución 120 g 100%
Usamos la regla de tres entre el soluto y la disolución para saber la masa del soluto:- Soluto: 12 g = 120 g × 10 / 100
-
soluto 12 g 10% disolvente ?? g disolución 120 g 100%
Calculamos los gramos de disolvente:- disolvente = Disolución - soluto
- disolvente: 108 g = 120 g - 12 g
-
soluto 12 g 10% disolvente 108 g disolución 120 g 100%
240 gramos de disolución al 8%
-
soluto ?? g 8% disolvente ?? g disolución 240 g 100%
Usamos la regla de tres entre el soluto y la disolución para saber la masa del soluto:- Soluto: 19,2 g = 240 g × 8 / 100
-
soluto 19,2 g 8% disolvente ?? g disolución 240 g 100%
Calculamos los gramos de disolvente:- disolvente = Disolución - soluto
- disolvente: 220,8 g = 240 g - 19,2 g
-
soluto 19,2 g 8% disolvente 220,8 g disolución 240 g 100%
Tercera disoluciónAhora mezclamos la primera y la segunda disolución para formar la tercera, es decir, sumamos los solutos, los disolventes y las disoluciones:
- soluto: 31,2 g = 12 g + 19,2 g
- disolvente: 328,8 g = 108 g + 220,8 g
- disolución: 360 g = 120 g + 240 g
-
soluto 31,2 g ??% disolvente 328,8 g disolución 360 g 100%
Por último, usamos una regla de tres entre el soluto y la disolución para saber la concentración:Concentración: 8,66% = 31,2 g × 100 / 360 g
-
soluto 31,2 g 8,66% disolvente 328,8g disolución 360 g 100%
Si quisiéramos saber el porcentaje del disolvente, podríamos encontrarlo de tres maneras:disolvente = Disolución - soluto Por regla de tres entre el soluto y el disolvente Por regla de tres entre la disolución y el disolvente 91,34 = 100 - 8.66 91,26 = 328.8 g × 8.66 / 31,2 g 91,33 = 328.8 g × 100 / 360 g soluto 31,2 g 8,66% disolvente 328,8 g 91,34% disolución 360 g 100% soluto 31,2 g 8,66% disolvente 328,8 g 91,26% disolución 360 g 100% soluto 31,2 g 8,66% disolvente 328,8 g 91.33% disolución 360 g 100% Nota: Los tres resultados son ligeramente diferentes por errores de redondeo en los cálculos de masa y porcentaje anteriores.
Molaridad
La molaridad (M), o concentración molar, es el número de moles de soluto por cada litro de disolución. Por ejemplo, si se disuelven 0,5 moles de soluto en 1000 mL de disolución, se tiene una concentración de ese soluto de 0,5 M (0,5 molar). Para preparar una disolución de esta concentración habitualmente se disuelve primero el soluto en un volumen menor, por ejemplo 300 mL, y se traslada esa disolución a un matraz aforado, para después enrasarlo con más disolvente hasta los 1000 mL.

Es el método más común de expresar la concentración en química, sobre todo cuando se trabaja con reacciones químicas y relaciones estequiométricas. Sin embargo, este proceso tiene el inconveniente de que el volumen cambia con la temperatura.
Se representa también como: M = n / V, en donde "n" son los moles de soluto(n=gr soluto/PM) y "V" es el volumen de la disolución expresado en litros.
Molalidad
La molalidad (m) es el número de moles de soluto que contiene un kilogramo de disolvente. Para preparar disoluciones de una determinada molalidad, no se emplea un matraz aforado como en el caso de la molaridad, sino que se puede hacer en un vaso de precipitados y pesando con una balanza analítica, previo peso del vaso vacío para poderle restar el correspondiente valor.

La principal ventaja de este método de medida respecto a la molaridad es que como el volumen de una disolución depende de la temperatura y de la presión, cuando éstas cambian, el volumen cambia con ellas. Gracias a que la molalidad no está en función del volumen, es independiente de la temperatura y la presión, y puede medirse con mayor precisión.
Es menos empleada que la molaridad pero igual de importante.
Formalidad
La formalidad (F) es el número de peso-fórmula-gramo o Masa Molecular por litro de disolución.

El número de peso-fórmula-gramo tiene unidad de g / PFG.
Normalidad
La normalidad (N) es el número de equivalentes (eq-g) de soluto (sto) por litro de disolución (Vsc).

El número de equivalentes se calcula dividiendo la masa total por la masa de un equivalente: n = m / meq, o bien como el producto de la masa total y la cantidad de equivalentes por mol, dividido por la masa molar:
 .
.Normalidad ácido-base
Es la normalidad de una disolución cuando se utiliza para una reacción como ácido o como base. Por esto suelen titularse utilizando indicadores de pH.
En este caso, los equivalentes pueden expresarse de la siguiente forma:
 para un ácido, o
para un ácido, o  para una base.
para una base.
Donde:
- n es la cantidad de equivalentes.
- moles es la cantidad de moles.
- H+ es la cantidad de protones cedidos por una molécula del ácido.
- OH– es la cantidad de hidroxilos cedidos por una molécula de la base.
Por esto, podemos decir lo siguiente:
 para un ácido, o
para un ácido, o  para una base.
para una base.
Donde:
- N es la normalidad de la disolución.
- M es la molaridad de la disolución.
- H+ es la cantidad de protones cedidos por una molécula del ácido.
- OH– es la cantidad de hidroxilos cedidos por una molécula de la base.
Ejemplos:
- Una disolución 1 M de HCl cede 1 H+, por lo tanto, es una disolución 1 N.
- Una disolución 1 M de Ca (OH)2 cede 2 OH–, por lo tanto, es una disolución 2 N.
Normalidad redox
Es la normalidad de una solución cuando se la utiliza para una reacción como agente oxidante o como agente reductor. Como un mismo compuesto puede actuar como oxidante o como reductor, suele indicarse si se trata de la normalidad como oxidante (Nox) o como reductor (Nrd). Por esto suelen titularse utilizando indicadores redox.
En este caso, los equivalentes pueden expresarse de la siguiente forma:
 .
.
Donde:
- n es la cantidad de equivalentes.
- moles es la cantidad de moles.
- e– es la cantidad de electrones intercambiados en la semirreacción de oxidación o reducción.
Por esto, podemos decir lo siguiente:
 .
.
Donde:
- N es la normalidad de la disolución.
- M es la molaridad de la disolución.
- e–: Es la cantidad de electrones intercambiados en la semirreacción de oxidación o reducción.
Ejemplos:
- En el siguiente caso vemos que el anión nitrato en medio ácido (por ejemplo el ácido nítrico) puede actuar como oxidante, y entonces una disolución 1 M es 3 Nox.
- En el siguiente caso vemos que el anión ioduro puede actuar como reductor, y entonces una disolución 1 M es 2 Nrd.
- En el siguiente caso vemos que el catión argéntico, puede actuar como oxidante, donde una solución 1 M es 1 Nox.
Concentraciones pequeñas
Para expresar concentraciones muy pequeñas, trazas de una sustancia muy diluida en otra, es común emplear las relaciones partes por millón (ppm), partes por "billón" (ppb) y partes por "trillón" (ppt). El millón equivale a 106, el billón estadounidense, o millardo, a 109 y el trillón estadounidense a 1012.
Es de uso relativamente frecuente en la medición de la composición de la atmósfera terrestre. Así el aumento de dióxido de carbono en el aire debido al calentamiento global se suele dar en dichas unidades.
Las unidades que se usan con más frecuencia son las siguientes:
- ppmm = μg × g–1
- ppmv = μg × ml–1
- ppbm = ng × g–1
- ppbv = ng × ml–1
- pptm = pg × g–1
- pptv = pg × ml–1
- *Nota: Se pone una v o una m al final según se trate de partes en volumen o en masa.
Sin embargo, a veces se emplean otras unidades.
Por ejemplo, 1 ppm de CO2 en aire podría ser, en algunos contextos, una molécula de CO2 en un millón de moléculas de componentes del aire.
Otro ejemplo: hablando de trazas en disoluciones acuosas, 1 ppm corresponde a 1 mg soluto/ kg disolución o, lo que es lo mismo, 1 mg soluto/ L disolución -ya que en estos casos, el volumen del soluto es despreciable, y la densidad del agua es 1 kg/L.
También se habla a veces de relaciones más pequeñas, por ejemplo "cuatrillón". Sin embargo son concentraciones excesivamente pequeñas y no se suelen emplear.
La IUPAC desaconseja el uso de estas relaciones (especialmente en el caso de masa entre volumen) y recomienda usar las unidades correspondientes.
Es particularmente delicado el uso de ppb y ppt, dado el distinto significado de billón y trillón en los entornos estadounidense y europeo.
Conversiones útiles
- Fracción molar a molalidad ( Xst→m ), y recordando que Xst + Xsv = 1
- Molalidad a molaridad ( m→M )
- Molaridad a molalidad ( M→m )
- Porcentaje en peso a porcentaje peso en volumen
- Peso en volumen a molaridad
Donde:- Psv = Peso molar del disolvente (g/mol)
- Pst = Peso molar del soluto (g/mol)
- d = densidad (g/mL)
- %P/P = Concentración en g soluto/100 g disolución
- %P/V = Concentración en g soluto/100 mL disolución
Otras formas de indicar la concentración
Para ciertas disoluciones de uso muy frecuente (por ejemplo ácido sulfúrico, hidróxido de sodio, etc.) se indica la concentración de otras formas:
Densidad
Si bien la densidad no es una forma de expresar la concentración, ésta es proporcional a la concentración (en las mismas condiciones de temperatura y presión). Por esto en ocasiones se expresa la densidad de la disolución en condiciones normales en lugar de indicar la concentración; pero se usa más prácticamente y con disoluciones utilizadas muy ampliamente. También hay tablas de conversión de densidad a concentración para estas disoluciones, aunque el uso de la densidad para indicar la concentración es una práctica que está cayendo en desuso.
Nombres propios
Algunas disoluciones se usan en una concentración determinada para algunas técnicas específicas. Y en estos casos suele usarse un nombre propio.
Ejemplos Compuesto Nombre Densidad Concentración H2SO4 Gerber 1,820-1,825 91,00-92,25 % m/m Alcohol isoamílico Gerber 0,810-0,812 Véase también
Enlaces externos
Categorías:- Magnitudes químicas
- Propiedades químicas
- Equilibrio químico
Wikimedia foundation. 2010.