- Centrosoma
-
Centrosoma
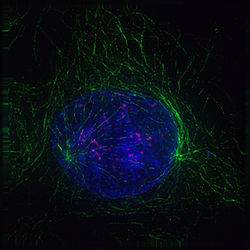 Profase (inicio de la mitosis): Los dos centros de origen de los microtúbulos (en verde) son los centrosomas. La cromatina ha comenzado a condensarse y se observan las cromátidas (en azul). Las estructuras en color rojo son los cinetocoros. (Micrografía obtenida utilizando marcajes fluorescentes).
Profase (inicio de la mitosis): Los dos centros de origen de los microtúbulos (en verde) son los centrosomas. La cromatina ha comenzado a condensarse y se observan las cromátidas (en azul). Las estructuras en color rojo son los cinetocoros. (Micrografía obtenida utilizando marcajes fluorescentes).
El centrosoma es un orgánulo celular que no está rodeado por una membrana; consiste de dos centriolos apareados, embebidos en un conjunto de agregados proteicos que los rodean y que se denomina “material pericentriolar” (PCM en inglés, por pericentriolar material).[1] [2] Su función primaria consiste en la nucleación y el anclaje de los microtúbulos (MTs), por lo que de forma genérica estas estructuras (conjuntamente con los cuerpos polares del huso en levaduras) se denominan centros organizadores de MTs (COMTs, en inglés MTOCs por microtubule organizing center). Alrededor de los centrosomas se dispone radialmente un conjunto de microtúbulos formando un áster. Los centrosomas tienen un papel fundamental en el establecimiento de la red de MTs en interfase y del huso mitótico. Durante la interfase del ciclo celular, los MTs determinan la forma celular, la polaridad y la motilidad, mientras que durante la mitosis, forman el huso mitótico, necesario para la segregación de los cromosomas entre las dos células hijas.
Por ello, el único centrosoma que existe durante G1 en interfase (formado por dos centriolos y el material pericentriolar que los rodea) debe duplicarse (aunque obligatoriamente sólo una vez). Como consecuecia, durante G2 la célula posee dos centrosomas, cada uno de ellos con dos centriolos estrechamente unidos. Estos dos centrosomas se separan durante las primeras etapas de la mitosis y se disponen en los polos opuestos de la célula, facilitando así el ensamblaje de un huso mitótico bipolar.
Las plantas superiores y los ovocitos de la mayor parte de las células animales carecen de centrosomas; en estos casos, el huso bipolar se forma por mecanismos alternativos, independientes de los centrosomas.[3]
Los centriolos son pequeñas estructuras en forma de barril, que están relacionadas estructuralmente (y pueden inter-convertirse) con los cuerpos basales, que por su parte son esenciales para la formación de cilios y flagelos. En vertebrados, los centriolos se componen de nueve tripletes de MTs, mientras que en Drosophila y en C. elegans casi siempre presentan MTs en doblete o unitarios, respectivamente.[4] El material pericentriolar que rodea los centriolos tiene un aspecto fibroso[5] y, en un centrosoma humano, contiene más de 100 proteínas diferentes.[6] Entre ellas se encuentran proteínas necesarias para la nucleación de los MTs (como la tubulina-γ) y otras proteínas asociadas, algunas de ellas conservadas en los cuerpos polares de los hongos (los equivalentes funcionales del centrosoma en este grupo).[7] Otras proteínas no están tan bien conservadas, pero muchas presentan dominios coiled-coil lo que indica que tienen probablemente una función estructural, sobre todo para capturar proteínas reguladoras del ciclo celular.[8]
En la mayor parte de las especies animales, el espermatozoide contribuye a la formación del embrión aportando un juego de cromosomas y, según las especies, uno o dos centriolos, que se combinan con proteínas presentes en el ovocito para reconstituir un centrosoma funcional.[4] Una vez formado el primer centrosoma en el embrión, este orgánulo debe duplicarse y segregarse en cada ciclo celular de manera sincrónica con el genoma.[9]
Contenido
Historia
Aunque fue visualizado en primer lugar por Walther Flemming en el mejillón de agua dulce en 1875,[10] así como por Edouard Van Beneden y A. Neyt[11] quienes observaron el "corpúsculo central" en el interior de los áster en embriones del nematodo parásito Parascaris equorum, el centrosoma fue descrito por vez primera por Theodor Boveri en el mismo organismo en 1887,[12] quien lo definió como un "orgánulo especializado en la división celular". Boveri identificó claramente el centrosoma como un par de centriolos rodeados por un material especial, capaz de ensamblar una "esfera de arquiplasma" que contiene todos esos elementos, que a su vez generan de forma transitoria una "astrosfera". En 1990, Boveri estableció que los centrosomas son orgánulos celulares de una única copia.[13] A través de su observación de la dinámica de los cromosomas (que identificó como constituidos de 2 cromátidas), llegó a la conclusión de que un huso mitótico bipolar típico consiste en realidad de dos medios husos, cada uno generado por un centrosoma, que se mantienen unidos por el conjunto de los cromosomas dobles unidos en el extremo de cada áster, de tal manera que cada cromosoma está unido a ambos polos, y sólo a uno por cromátida. Por tanto, dedujo que durante la formación de la placa metafásica, existen fuerzas cromosómicas que parecen contrarrestar la repulsión existente entre los áster. Asimismo, Boveri describió correctamente el ciclo del centrosoma.
El ciclo del centrosoma
Las etapas fundamentales del ciclo del centrosoma están resumidas de forma esquemática en la figura de la izquierda. En una célula en división (fase M), en cada extremo del huso mitótico se encuentra un centrosoma, compuesto por dos centriolos posicionados ortogonalmente (en un ángulo de 90°). De esta forma, al final de la mitosis cada célula hija recibirá 1 centrosoma con 2 centriolos. Al final de la fase M, los 2 centriolos se separan en un proceso denominado "desacoplamiento" (o "desorientación"). Según un modelo reciente, el desacoplamiento de los centriolos es un evento necesario para permitir la duplicación subsiguiente, que contribuye a asegurar que los centriolos se dupliquen sólo una vez en cada ciclo celular.[14] También se piensa que el desacoplamiento permite el establecimiento de una conexión proteinácea que mantendrá unidos los 2 futuros centriolos "padres" estrechamente unidos en el siguiente ciclo celular.[15] En las células animales, la iniciación de la replicación del ADN y la duplicación del centrosoma están acopladas al menos parcialmente por la activación específica en G1 de la ciclina dependiente de kinasa 2 (CDK2)-ciclina E,[16] pues los centriolos (como el ADN) se duplican durante la fase S del ciclo celular.[17] Durante este proceso clave del ciclo del centrosoma, al lado de cada centriolo "padre" se forma exactamente 1 procentriolo. Los 2 nuevos procentriolos continuan elongándose después, de manera que en G2 el centrosoma está formado por dos pares de centriolos. Hasta este momento, los dos pares de centriolos funcionan como un único MTOC, lo que indica que están conectados de forma estructural.[18] En la transición G2/M, la conexión entre los 2 centriolos "padres" se escinde, y los dos nuevos centrosomas se separan mediante la acción de proteínas motoras dependientes de microtúbulos.[19] Al mismo tiempo, tiene lugar un proceso denominado "maduración" de los centrosomas,[20] que resulta en la incorporación de nuevos complejos γ-TuRC (véase tubulina-γ) y permite un aumento de la actividad de nucleación de microtúbulos. Después de la formación del huso mitótico, los 2 centrosomas se asocian con los 2 polos del huso, segregándose con las dos futuras células hijas y completando así el ciclo del centrosoma.
Durante el ciclo celular, los mecanismos que aseguran la replicación del ADN y la correcta segregación de los cromosomas son fundamentalmente post-traduccionales: fosforilación y proteolisis (véase también regulación de la progresión del ciclo celular).[21] Como era de esperar, estos mecanismos también ejercen una función fundamental en el ciclo del centrosoma, de manera que contribuyen a la coordinación de éste con el ciclo de los cromosomas. En concreto, la fosforilación de la proteína Retinoblastoma (pRb) es un evento crítico en dicha coordinación.[22] Otras proteínas implicadas en la regulación del ciclo del centrosoma, además de pRb y cdk2/ciclina-E (mencionadas anteriormente) son Plk4 (también denominada Sak),[23] y algunas otras kinasas que se encuentran desreguladas en tumores, como Plk1, Aurora-A y Nek2.[24] [25] [26]
Por su parte, la proteolisis tiene lugar al final de la mitosis, cuando se rompe la estrecha asociación existente entre los 2 centriolos en cada polo del huso. Algunos estudios indican que la proteasa responsable de este proceso es la Separasa,[27] una enzima que fue identificada originalmente por su función en la separación de cromátidas hermanas (véase también disolución de la cohesión).[28]
Funciones
Sus funciones están relacionadas con la motilidad celular y con la organización del citoesqueleto. Durante la división celular los centrosomas se dirigen a polos opuestos de la célula, organizando el huso acromático (o mitótico). En el periodo de anafase los microtúbulos del áster estiran la célula y contribuyen a la separación de los cromosomas a cromátidas y a la división del citoplasma.
Alteraciones de los centrosomas en células cancerosas
El hecho de que los centrosomas se encuentren frecuentemente alterados en las células cancerosas fue una observación temprana realizada por el descubridor de este orgánulo, Theodor Boveri, a finales del siglo XIX. Esta observación inicial se ha extendido posteriormente a muchos tipos de tumores humanos.[29] Las alteraciones de los centrosomas pueden ser de dos tipos, estructurales o numéricas, aunque ambas pueden encontrarse simultáneamente.
Aberraciones estructurales
Normalmente aparecen debido a la expresión descontrolada de componentes del centrosoma, o bien por modificaciones post-traduccionales (como fosforilaciones, por ejemplo) inadecuadas de dichos componentes. Estas variaciones pueden provocar variaciones en el tamaño de los centrosomas (a menudo centrosomas mayores de lo normal, debido a una acumulación excesiva de material pericentriolar). Además, debido a la propensión de las proteínas centrosómicas a formar agregados, a menudo se observan "cuerpos relacionados con el centrosoma" (en inglés, CRBs por centrosome-related bodies) en sitios ectópicos.[30] Tanto los centrosomas agrandados como los CRBs son similares a las estructuras observadas en tumores,[31] y pueden inducirse en células en cultivo mediante la sobre-expresión de determinadas proteínas centrosómicas, como CNap-1 o Nlp.[30] [19] Aunque estas estructuras pueden parecen similares entre sí, estudios detallados revelan que pueden presentar propiedades muy diferentes, en función de su composición proteica. Por ejemplo, su capacidad de incorporar complejos γ-TuRC (véase tubulina-γ) puede variar mucho, y consecuentemente su capacidad de nucleación de microtúbulos puede ser también muy variable,[31] afectando de manera diferente la forma, polaridad y motilidad de las células tumorales implicadas.
Aberraciones numéricas
La presencia de un número inadecuado de centrosomas a menudo coexiste con la existencia de inestabilidad genómica y la pérdida de diferenciación tisular.[31] [32] Sin embargo, el recuento exacto de centrosomas (cada uno con 2 centriolos), es a menudo impreciso, ya que suele hacerse mediante microscopía de fluorescencia, un método cuyo poder de resolución no es el óptimo. A pesar de todo, está claro que la presencia de centrosomas super-numerarios (en exceso) es común en la mayor parte de los tumores humanos. Se ha observado que la carencia de la proteína supresora de tumores p53 produce centrosomas super-numerarios,[33] así como la desregulación de otras proteínas implicadas en el proceso de carcinogénesis en humanos, como por ejemplo BRCA1 y BRCA2 (para referencias, véase[29] ). Es importante indicar que los centrosomas super-numerarios pueden generarse por mecanismos diferentes: re-duplicación específica del centrosoma, fallo en la división celular (que resulta en un incremento en el número cromosómico), fusión celular (por ejemplo debido a la infección por determinados virus) o generación de centrosomas de novo. En la actualidad no hay suficientes datos para saber con qué frecuencia opera cada uno de estos mecanismos in vivo, aunque es posible que el aumento en el número de centrosomas debido a un fallo en la división celular sea más frecuente de lo que se suele apreciar, porque muchos defectos "primarios" en una célula (desregulación del ciclo celular, metabolismo del ADN o de la cromatina defectuoso, fallo en el checkpoint de mitosis, etc...) producirían un fallo en la división celular, generando un aumento de la ploidía y un aumento en el número de centrosomas de manera "secundaria".[34] [35]
Referencias
- ↑ Nigg (2007), "Centrosome duplication: of rules and licenses", Trends in Cell Biology 17 (5): 215–221, doi:
- ↑ Fukasawa, K. (2007), "Oncogenes and tumour suppressors take on centrosomes", Nature Reviews Cancer 7: 911–924, doi:
- ↑ Heald, Gadde (2004), "Mechanisms and molecules of the mitotic spindle", Current Biology 14 (18): R797–R805, doi:
- ↑ a b Delattre, M.; Gonczy, P. (2004), "The arithmetic of centrosome biogenesis", J Cell Sci 117: 1619–1630, http://jcs.biologists.org/cgi/content/full/117/9/1619
- ↑ Dictenberg, J. B.; Zimmerman, W.; Sparks, C. A.; Young, D. A.; Vidair, C.; Yi Zheng, par; Carrington, W.; F. S. Fay, Dagger et al. (1998), "Pericentrin and gamma -Tubulin Form a Protein Complex and Are Organized into a Novel Lattice at the Centrosome", J Cell Biol 141 (1): 163–174, http://jcb.rupress.org/cgi/content/full/141/1/163
- ↑ Andersen, J. S.; Wilkinson, C. J.; Mayor, T.; Mortensen, P.; Nigg, E. A.; Mann, M., "Proteomic characterization of the human centrosome by protein correlation profiling", Nature 426: 570–574, http://www.nature.com/nature/journal/v426/n6966/full/nature02166.html, consultado el 2009-07-09
- ↑ Naone, S. van Kreeveld; Winey, M. (2004), "The Budding Yeast Spindle Pole Body: A Centrosome Analog", Centrosomes in Development and Disease (ed. E.A. Nigg): 43–62, http://books.google.fr/books?id=HymsJwBEVggC&printsec=frontcover&hl=en, consultado el 2009-07-09
- ↑ Doxsey, S.; McCollum, D.; Theurkauf, W. (2005), "Centrosomes in cellular regulation", Annual Reviews 21: 411–434, doi:
- ↑ Mazia, D. (1987), "The chromosome cycle and the centrosome cycle in the mitotic cycle", International review of cytology 100: 49–92, PMID 3549609
- ↑ , Flemming, W. (1875), "Studien über die Entwicklungsgeschichte der Najaden", Sitzungsgeber Akad Wissensch Wien 71: 81–147
- ↑ Van Beneden, E.; Neyt, A. (1887), "Nouvelles recherches sur la fécondation et la division mitosique chez l’Ascaride mégalocéphale,", Bull. Acad. Roy. Sci. Belg. 14: 255–295
- ↑ Boveri, T. (1887), "Ueber die Befruchtung der Eier von Ascaris megalocephala.", Sitz-Ber. Ges. Morph. Phys. München 3.
- ↑ Boveri, T., "Zellenstudien IV. Uber die Natur der Centrosomen", Jena Z. Naturwiss. 35: 1–220
- ↑ Tsou, M.F.; Stearns, T. (2006), "Controlling centrosome number: licenses and blocks.", Curr Opin Cell Biol 18: 74–78, doi:
- ↑ Mayor, T.; Stierhof, Y.D.; Tanaka, K.; Fry, A.M.; Nigg, E.A. (2000), "The centrosomal protein C-Nap1 is required for cell cycle-regulated centrosome cohesion", J Cell Biol 151: 837–846, doi:
- ↑ Hinchcliffe, E.H.; Sluder, G. (2002), "Two for two: Cdk2 and its role in centrosome doubling", Oncogene 76: 35–51, doi:
- ↑ Sluder, G. (2004), "Centrosome duplication and its regulation in higher animal cells", Nigg EA, ed. Centrosomes in development and disease. Weinheim: Wiley-VCH: 167–189
- ↑ Bahe, S.; Stierhof, Y.D.; Wilkinson, C.J.; Leiss, F.; Nigg, E.A. (2005), "Rootletin forms centriole-associated filaments and functions in centrosome cohesion", J Cell Biol 171: 27–33, doi:
- ↑ a b Fry, A.M.; Mayor, T.; Meraldi, P.; Stierhof, Y.D.; Tanaka, K.; Nigg, E.A. (1998), "CNap1, a novel centrosomal coiled-coil protein and candidate substrate of the cell cycle-regulated protein kinase Nek2", J Cell Biol 141: 1563–1574, http://jcb.rupress.org/cgi/content/abstract/141/7/1563, consultado el 2009-07-29
- ↑ Palazzo, R.E.; Vogel, J.M.; Schnackenberg, B.J.; Hull, D.R.; Wu, X., "Centrosome maturation", Curr Top Dev Biol 49: 449–470, PMID 11005031
- ↑ Pines, J. (2006), "Mitosis: a matter of getting rid of the right protein at the right time", Trends Cell Biol 16: 55–63, doi:
- ↑ Meraldi, P.; Lukas, J.; Fry, A.M.; Bartek, J.; Nigg, E.A. (1999), "Centrosome duplication in mammalian somatic cells requires E2F and Cdk2-cyclin A", Nat Cell Biol 1: 88–93, doi:
- ↑ Habedanck, R.; Stierhof, Y.D.; Wilkinson, C.J.; Nigg, E.A. (2005), "The polo kinase Plk4 functions in centriole duplication", Nat Cell Biol 7: 1140–1146, doi:
- ↑ Hayward, D.G.; Clarke, R.B.; Faragher, A.J.; Pillai, M.R.; Hagan, I.M.; Fry, A.M. (2004), "The centrosomal kinase Nek2 displays elevated levels of protein expression in human breast cancer.", Cancer Res 64: 7370–7376, http://cancerres.aacrjournals.org/cgi/content/abstract/64/20/7370, consultado el 2009-07-30
- ↑ Strebhardt, K.; Ullrich, A. (2006), "Targeting polo-like kinase 1 for cancer therapy", Nat Rev Cancer 6: 321–330, doi:
- ↑ Meraldi, P.; Honda, R.; Nigg, E.A. (2004), "Aurora kinases link chromosome segregation and cell division to cancer susceptibility", Curr Opin Genet Dev 14: 29–36, doi:
- ↑ Tsou, M.F.; Stearns, T. (2006), "Mechanism limiting centrosome duplication to once per cell cycle", Nature 442 (7105): 947–951, PMID 16862117
- ↑ Uhlmann, F. (2004), "The mechanism of sister chromatid cohesion", Exp Cell Res 296: 80–85, PMID 15120997
- ↑ a b Nigg, E.A. (2002), "Centrosome aberrations: cause or consequence of cancer progression?", Nat Rev Cancer 2: 815–821, PMID 12415252
- ↑ a b Casenghi, M.; Meraldi, P.; Weinhart, U.; Duncan, P.I.; Korner, R.; Nigg, E.A. (2003), "Polo-like kinase 1 regulates Nlp, a centrosome protein involved in microtubule nucleation", Dev Cell 5: 113–125, doi:
- ↑ a b c Lingle, W.L.; Barrett, S.L.; Negron, V.C.; D'assoro, A.B.; Boeneman, K.; Liu W. Whitehead C.M.; Reynolds, C.; Salisbury, J.L. (2002), "Centrosome amplification drives chromosomal instability in breast tumor development", Proc Natl Acad Sci USA 99: 1978–1983, PMID 11830638
- ↑ Ghadimi, B.M.; Sackett, D.L.; Difilippantonio, M.J.; Schrock, E.; Neumann, T.; Jauho, A.; Auer, G.; Ried, T. (2000), "Centrosome amplification and instability occurs exclusively in aneuploid, but not in diploid colorectal cancer cell lines, and correlates with numerical chromosomal aberrations", Genes Chromosomes Cancer 27: 183–190, PMID 10612807
- ↑ Fukasawa, K.; Choi, T.; Kuriyama, R.; Rulong, S.; Woude, Vande G.F. (1996), "Abnormal centrosome amplification in the absence of p53", Science 271: 1744–1747, doi:
- ↑ Meraldi, P.; Honda, R.; Nigg, E.A. (2002), "Aurora-A overexpression reveals tetraploidization as a major route to centrosome amplification in p53-/- cells", EMBO J 21: 483–492, doi:
- ↑ Storchova, Z.; Pellman, D. (2004), "From polyploidy to aneuploidy, genome instability and cancer", Nat Rev Mol Cell Biol. 5: 45–54, PMID 14708009
Enlaces externos
Categoría: Orgánulos celulares
Wikimedia foundation. 2010.

