- 1,1-carbonildiimidazol
-
El 1,1-carbonildiimidazol, o CDI, (fórmula (C3H3N2)2CO), es un compuesto orgánico sólido cristalino blanco. Se le usa frecuentemente para unir aminoácidos en síntesis de péptidos, y como reactivo en síntesis orgánica.
Contenido
Preparación
El CDI puede ser preparado directamente por reacción del fosgeno con cuatro equivalentes de imidazol en condiciones anhidras.[1] La eliminación del subproducto cloruro de imidazolio, y del solvente lleva al producto cristalino en un rendimiento de aproximadamente el 90%.[2]
- 4 editar] Aplicación en síntesis
El CDI se usa principalmente para convertir alcoholes y aminas en carbamatos, ésteres, y ureas.[1]
Esquema general de reacciónDerivados de ácido
Una extensión común de este esquema es en la reacción de transacilación de ácidos, que es promovida por el CDI. Aunque la reactividad del CDI es menor que la de los cloruros de ácido, es más fácilmente manipulable, y sus reacciones han tenido un alcance más amplio en síntesis.[3] Una de las primeras aplicaciones de este tipo de reacción fue observado en la formación de derivados de péptido de imidazol (y en general de ácidos carboxílicos), con la formación de CO2 como desplazadora del equilibrio hacia la derecha.
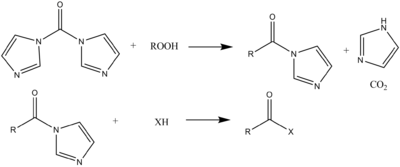
En el campo de la síntesis de péptidos, este producto puede ser tratado con un aminoácido o un éster de péptido (o clorhidrato de aminoácido en agua) para liberar el grupo imidazol y acoplar a los péptidos. Los subproductos, dióxido de carbono e imidazol, son relativamente inocuos.[4] También tiende a ser mínima la racemización de los aminoácidos, debido a las condiciones mucho más suaves de reacción.
El CDI puede ser usado para la esterificación, aunque la alcohólisis requiere calor o la presencia de un nucleófilo potente como es el etóxido de sodio,[1] [3] ) y otras bases fuertes como el NaH. Generalmente, esta reacción tiene un rendimiento alto y aplicaciones muy amplias (aunque la formación de éster cuando el reactivo ácido tiene un protón α relativamente ácido es problemática, puesto que puede darse condensación C-C, aunque esto puede ser una reacción deseable).name="staab1" /> Una reacción similar que involucra a los tioles y selenoles puede conducir a los ésteres correspondientes.[5] La reacción del alcohol puede ser usada también para formar enlaces glicosídicos.[6]
De un modo similar, un ácido puede ser usado en vez de un alcohol para formar el anhídrido. El equilibrio se desplaza mejor en favor del anhídrido utilizando un ácido en razón 2:1, que forma una sal insoluble con el imidazol, tal como el ácido tricloroacético o el trifluoroacético (con lo que elimina el imidazol libre de la reacción). Los anhídridos simétricos pueden ser usados luego reemplazando el grupo trifluoroacetilo o tricloroacetilo con el ácido que fue usado para formar el reactivo original.
Otra reacción relacionada es la reacción del ácido fórmico con el CDI para formar el imidazol formilado. Este reactivo es un buen agente formilante y puede regenerar el imidazol no sustituido (con formación de monóxido de carbono) al calentarse.
Aún otra reacción involucra la acilación de trifenilalquilidenfosforanos.
-
- (C6H5)3P=CHR + R'-CO-Im → (C6H5)3P+-CHR-COR' + Im-
(C6H5)3P+-CHR-COR' + (C6H5)3P=CHR → (C6H5)3P=CR-COR' + (C6H5)3P+-CH2R
- (C6H5)3P=CHR + R'-CO-Im → (C6H5)3P+-CHR-COR' + Im-
Y estos pueden luego ser sometidos a la reacción de Wittig para formar cetonas o aldehídos α,β-insaturados.
El reactivo incluso puede sufrir una reacción con peróxido para formar el ácido peroxicarboxílico, que puede reaccionar posteriormente para formar peróxidos de diacilo. El grupo imidazol puede ser reducido también por reactivos de Grignard para formar cetonas.[1]
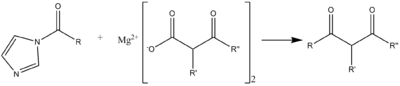
Puede darse una reacción de acilación C-C con un compuesto del tipo del éster malónico, en el siguiente esquema de reacción, lo que es muy útil para la síntesis de antibióticos macrólidos.[7]
Otras reacciones
Puede formarse el derivado N-fenilimino del CDI en una reacción tipo Wittig.[1]
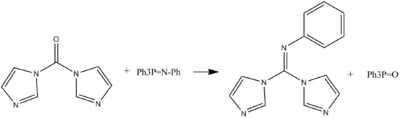
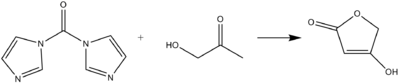
El CDI puede actuar como un equivalente de carbonilo en la formación de ácidos tetrónicos o pulvinonas a partir de hidroxicetonas y dicetonas en condiciones alcalinas.[8]
Un alcohol tratado con al menos 3 equivalentes de un halogenuro activado (como un bromuro de alilo o yodometano) y CDI conduce al correspondiente halogenuro con un buen rendimiento. La bromación y yodación dan los mejores resultados, aunque esta reacción no conserva la estereoquímica del alcohol. En un contexto similar, el CDI se usa frecuentemente en reacciones de deshidratación.[3]
Como el CDI es análogo al fosgeno, puede ser usado en reacciones similaress, aunque con mayor selectividad: permite la síntesis de carbonatos de bis alquilo asimétricos.[9]
Referencias
- ↑ a b c d e H.A. Staab (1962). «Syntheses Using Heterocyclic Amides (Azolides)». Angewandte Chemie International Edition in English 1: pp. 351–367. doi:.
- ↑ H.A. Staab and K. Wendel (1973). "1,1'-Carbonyldiimidazole". Org. Synth.; Coll. Vol. 5: 201.
- ↑ a b c d A. Armstrong (2001). «N,N'-Carbonyldiimidazole». Encyclopedia of Reagents for Organic Synthesis. doi:.
- ↑ R. Paul and G. W. Anderson (1960). «N,N'-Carbonyldiimidazole, a New Peptide Forming Reagent'». Journal of the American Chemical Society 82: pp. 4596–4600. doi:.
- ↑ H.-J. Gais (1977). «Synthesis of Thiol and Selenol Esters from Carboxylic Acids and Thiols or Selenols, Respectively». Angewandte Chemie International Edition in English 16: pp. 244–246. doi:.
- ↑ M.J. Ford and S.V. Ley (1990). «A Simple, One-Pot, Glycosidation Procedure via (1-Imidazolylcaronyl) Glycosides and Zinc Bromide». Synlett 1990: pp. 255–256. doi:.
- ↑ D.W. Brooks, et al. (1979). «C-Acylation under Virtually Neutral Conditions». Angewandte Chemie International Edition in English 18: pp. 72–74. doi:.
- ↑ P.J. Jerris, et al. (1979). «A Facile Synthesis of Simple Tetronic Acids And Pulvinones». Tetrahedron Letters 47: pp. 4517–4520. doi:.
- ↑ Steve P. Rannard, Nicola J. Davis (1999). «Controlled Synthesis of Asymmetric Dialkyl and Cyclic Carbonates Using the Highly Selective Reactions of Imidazole Carboxylic Esters». Organic Letters 1: pp. 933–936. doi:.
-
Categoría:- Imidazoles
- 4 editar] Aplicación en síntesis
Wikimedia foundation. 2010.