- Orbital atómico
-
 Orbitales atómicos y moleculares. El esquema de la izquierda es la regla de Madelung para determinar la secuencia energética de orbitales. El resultado es la secuencia inferior de la imagen. Hay que tener en cuenta que los orbitales son función de tres variables, la distancia al núcleo, r y dos ángulos. Las imágenes sólo representan la componente angular del orbital.
Orbitales atómicos y moleculares. El esquema de la izquierda es la regla de Madelung para determinar la secuencia energética de orbitales. El resultado es la secuencia inferior de la imagen. Hay que tener en cuenta que los orbitales son función de tres variables, la distancia al núcleo, r y dos ángulos. Las imágenes sólo representan la componente angular del orbital.
Un orbital atómico es una determinada solución particular, espacial e independiente del tiempo a la ecuación de Schrödinger para el caso de un electrón sometido a un potencial coulombiano. La elección de tres números cuánticos en la solución general señalan unívocamente a un estado monoelectrónico posible.
Estos tres números cuánticos hacen referencia a la energía total del electrón, el momento angular orbital y la proyección del mismo sobre el eje z del sistema del laboratorio y se denotan por
El nombre de orbital también atiende a la función de onda en representación de posición independiente del tiempo de un electrón en una molécula. En este caso se utiliza el nombre orbital molecular.
La combinación de todos los orbitales atómicos dan lugar a la corteza electrónica representado por el modelo de capas electrónico. Este último se ajusta a los elementos según la configuración electrónica correspondiente.
Contenido
Introducción
El orbital es la descripción ondulatoria del tamaño, forma y orientación de una región del espacio disponible para un electrón.[1] Cada orbital con diferentes valores de n presenta una energía específica para el estado del electrón.
La posición (la probabilidad de la amplitud) de encontrar un electrón en un punto determinado del espacio se define mediante sus coordenadas en el espacio. En coordenadas cartesianas dicha probabilidad se denota como
 , donde ϕ no se puede medir directamente.
, donde ϕ no se puede medir directamente.Al suponer en los átomos simetría esférica, se suele trabajar con la función de onda en términos de coordenadas esféricas,
 .
.Fundamentos físicos
La función de ondas
En el modelo atómico surgido tras la aplicación de la mecánica cuántica a la descripción de los electrones en los átomos (modelo posterior al modelo atómico de Bohr),[2] se denomina orbital atómico a cada una de las funciones de onda monoelectrónicas que describen los estados estacionarios y espaciales de los átomos hidrogenoides. Es decir, son los estados físicos estacionarios en representación de posición,
 , que se obtienen resolviendo la ecuación de Schrödinger independiente del tiempo
, que se obtienen resolviendo la ecuación de Schrödinger independiente del tiempo  , es decir, las funciones propias del operador hamiltoniano, No se pudo entender (La conversión a PNG ha sido errónea): \hat\mathcal{H} ).
, es decir, las funciones propias del operador hamiltoniano, No se pudo entender (La conversión a PNG ha sido errónea): \hat\mathcal{H} ).No representan la posición concreta de un electrón en el espacio, que no puede conocerse dada su naturaleza mecanocuántica, sino que representan una región del espacio en torno al núcleo atómico en la que la probabilidad de encontrar al electrón es elevada (por lo que en ocasiones al orbital se le llama Región espacio energética de manifestación probabilística electrónica o REEMPE).
Los números cuánticos
En el caso del átomo de hidrógeno, se puede resolver la ecuación de Schrödinger de forma exacta, encontrando que las funciones de onda están determinadas por los valores de tres números cuánticos n, l, ml, es decir, dicha ecuación impone una serie de restricciones en el conjunto de soluciones que se identifican con una serie de números cuánticos. Estas condiciones surgen a través de las relaciones existentes entre estos números; no todos los valores son posibles físicamente.
- El valor del número cuántico n (número cuántico principal, toma valores 1,2,3...) define el tamaño del orbital. Cuanto mayor sea, mayor será el volumen. También es el que tiene mayor influencia en la energía del orbital.
- El valor del número cuántico l (número cuántico del momento angular) indica la forma del orbital y el momento angular. El momento angular viene dado por:
La notación (procedente de la espectroscopia) es la siguiente:
-
- Para l = 0, orbitales s
- Para l = 1, orbitales p
- Para l = 2, obitales d
- Para l = 3, orbitales f
- Para l = 4, orbitales g; siguiéndose ya el orden alfabético.
El nombre que se asigna a las distintas clases de orbitales se debe a su relación con las líneas del espectro de un elemento (en inglés s sharp, p principal, d diffuse y f fundamental y el resto de los nombres, a partir de aquí, siguen el orden alfabético g, h ).
- El valor de ml (número cuántico magnético) define la orientación espacial del orbital frente a un campo magnético externo. Para la proyección del momento angular frente al campo externo, se verifica:
Posteriormente se tuvo la necesidad de incluir ad hoc el espín del electrón, el cual viene descrito por otros dos números cuánticos s y ms. En la mecánica cuántica relativista el espín surge de forma espontánea y no hace falta introducirlo a mano.
- El valor de s (número cuántico de espín) para el electrón es 1/2, mientras que ms puede tomar los valores +1/2 ó -1/2 (cuando no se tiene en cuenta el espín se dice que el orbital es un orbital espacial mientras que si se considera el espín, se denomina espín orbital).
La función de onda se puede descomponer, empleando como sistema de coordenadas las coordenadas esféricas, de la siguiente forma:
donde Rn,l(r) representa la parte del orbital que depende de la distancia del electrón al núcleo y
 es la parte que depende de los ángulos (geometría sobre una esfera unidad) del orbital y son los armónicos esféricos:
es la parte que depende de los ángulos (geometría sobre una esfera unidad) del orbital y son los armónicos esféricos:Para la representación gráfica del orbital se emplea la función cuadrado,
 y
y  , ya que ésta es proporcional a la densidad de carga y por tanto a la densidad de probabilidad, es decir, el volumen que encierra la mayor parte de la probabilidad de encontrar al electrón o, si se prefiere, el volumen o región del espacio en la que el electrón pasa la mayor parte del tiempo.
, ya que ésta es proporcional a la densidad de carga y por tanto a la densidad de probabilidad, es decir, el volumen que encierra la mayor parte de la probabilidad de encontrar al electrón o, si se prefiere, el volumen o región del espacio en la que el electrón pasa la mayor parte del tiempo.Más allá del átomo de hidrógeno
En sentido estricto, los orbitales son construcciones matemáticas que tratan de describir, de forma coherente con la mecánica cuántica, los estados estacionarios de un electrón en un campo eléctrico de simetría central. (Dado que el núcleo no está descrito de forma explícita, ni siquiera describen de forma completa al átomo de hidrógeno).
Estas construcciones matemáticas no están preparadas, por su origen monoelectrónico, para tener en cuenta ni la correlación entre electrones ni la antisimetría exigida por la estadística de Fermi (los electrones son fermiones).
Sin embargo, saliéndose de su sentido estricto, han demostrado ser de enorme utilidad para los químicos, de forma que se utilizan no solo para sistemas polielectrónicos, sino también para sistemas polinucleares (como las moléculas). También, más allá de su sentido estricto, los químicos se refieren a ellos como entes físicos más que como construcciones matemáticas, con expresiones como «en un orbital caben dos electrones».[cita requerida]
Formas de los orbitales
Por simplicidad, se recogen las formas de la parte angular de los orbitales, obviando los nodos radiales, que siempre tienen forma esférica.
Orbital s
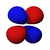
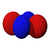
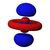
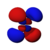
El orbital s tiene simetría esférica alrededor del núcleo atómico. En la figura siguiente se muestran dos formas alternativas para representar la nube electrónica de un orbital s: en la primera, la probabilidad de encontrar al electrón (representada por la densidad de puntos) disminuye a medida que nos alejamos del centro; en la segunda, se representa el volumen esférico en que el electrón pasa la mayor parte del tiempo y por ultimo se observa el electrón.

Orbital p
La forma geométrica de los orbitales p es la de dos esferas achatadas hacia el punto de contacto (el núcleo atómico) y orientadas según los ejes de coordenadas. En función de los valores que puede tomar el tercer número cuántico ml (-1, 0 y 1) se obtienen los tres orbitales p simétricos respecto a los ejes x, z e y. Análogamente al caso anterior, los orbitales p presentan n-2 nodos radiales en la densidad electrónica, de modo que al incrementarse el valor del número cuántico principal la probabilidad de encontrar el electrón se aleja del núcleo atómico. El orbital "p" representa también la energía que posee un electrón y se incrementa a medida que se aleja entre la distancia del núcleo y el orbital.

Orbital d
Los orbitales d tienen formas más diversas
- cuatro de ellos tienen forma de 4 lóbulos de signos alternados (dos planos nodales, en diferentes orientaciones del espacio), y el último es un doble lóbulo rodeado por un anillo (un doble cono nodal). Siguiendo la misma tendencia, presentan n-3 nodos radiales.

Orbital f
Los orbitales f tienen formas aún más exóticas, que se pueden derivar de añadir un plano nodal a las formas de los orbitales d. Presentan n-4 nodos radiales.

Tabla de orbitales
La tabla siguiente muestra todas las configuraciones orbitales para el hidrógeno, como funciones de onda, desde el 1s al 7s. Los átomos polielectrónicos irían alojando sus electrones en dichos grupos de orbitales.
Véase también
Referencias
- ↑ Milton Orchin,Roger S. Macomber, Allan Pinhas, and R. Marshall Wilson(2005)"Atomic Orbital Theory"
- ↑ Bohr, Niels (1913). «On the Constitution of Atoms and Molecules». Philosophical Magazine 26 (1): pp. 476.
Enlaces externos
 Wikimedia Commons alberga contenido multimedia sobre Orbital atómico. Commons
Wikimedia Commons alberga contenido multimedia sobre Orbital atómico. Commons
Wikimedia foundation. 2010.