- Solubilidad
-
La solubilidad es una medida de la capacidad de disolverse una determinada sustancia (soluto) en un determinado medio (solvente); implícitamente se corresponde con la máxima cantidad de soluto disuelto en una dada cantidad de solvente a una temperatura fija y en dicho caso se establece que la solución está saturada. Su concentración puede expresarse en moles por litro, en gramos por litro, o también en porcentaje de soluto (m(g)/100 mL) . El método preferido para hacer que el soluto se disuelva en esta clase de soluciones es calentar la muestra y enfriar hasta temperatura ambiente (normalmente 25 C). En algunas condiciones la solubilidad se puede sobrepasar de ese máximo y pasan a denominarse como 'soluciones sobresaturadas'.
No todas las sustancias se disuelven en un mismo solvente. Por ejemplo, en el agua, se disuelve el alcohol y la sal, en tanto que el aceite y la gasolina no se disuelven. En la solubilidad, el carácter polar o apolar de la sustancia influye mucho, ya que, debido a este carácter, la sustancia será más o menos soluble; por ejemplo, los compuestos con más de un grupo funcional presentan gran polaridad por lo que no son solubles en éter etílico.
Entonces para que un compuesto sea soluble en éter etílico ha de tener escasa polaridad; es decir, tal compuesto no ha de tener más de un grupo polar. Los compuestos con menor solubilidad son los que presentan menor reactividad como son: las parafinas, compuestos aromáticos y los derivados halogenados.
El término solubilidad se utiliza tanto para designar al fenómeno cualitativo del proceso de disolución como para expresar cuantitativamente la concentración de las soluciones. La solubilidad de una sustancia depende de la naturaleza del disolvente y del soluto, así como de la temperatura y la presión del sistema, es decir, de la tendencia del sistema a alcanzar el valor máximo de entropía. Al proceso de interacción entre las moléculas del disolvente y las partículas del soluto para formar agregados se le llama solvatación y si el solvente es agua, hidratación.
Contenido
Factores que afectan la solubilidad
La solubilidad se define para fases específicas. Por ejemplo, la solubilidad de aragonito y calcita en el agua se espera que difieran, si bien ambos son polimorfos de carbonato de calcio y tienen la misma fórmula química.
La solubilidad de una sustancia en otra está determinada por el equilibrio de fuerzas intermoleculares entre el disolvente y el soluto, y la variación de entropía que acompaña a la solvatación. Factores como la temperatura y la presión influyen en este equilibrio, cambiando así la solubilidad.
La solubilidad también depende en gran medida de la presencia de otras sustancias disueltas en el disolvente como por ejemplo la existencia de complejos metálicos en los líquidos. La solubilidad dependerá también del exceso o defecto de algún ion común, con el soluto, en la solución; tal fenómeno es conocido como el efecto del ion común. En menor medida, la solubilidad dependerá de la fuerza iónica de las soluciones. Los dos últimos efectos mencionados pueden cuantificarse utilizando la ecuación de equilibrio de solubilidad.
Para un sólido que se disuelve en una reacción redox, la solubilidad se espera que dependa de las posibilidades (dentro del alcance de los potenciales en las que el sólido se mantiene la fase termodinámicamente estable). Por ejemplo, la solubilidad del oro en el agua a alta temperatura se observa que es casi de un orden de magnitud más alta cuando el potencial redox se controla mediante un tampón altamente oxidante redox Fe2O3-Fe3O4 que con un tampón moderadamente oxidante Ni-NiO.[1]
La solubilidad (metaestable) también depende del tamaño físico del grano de cristal o más estrictamente hablando, de la superficie específica (o molar) del soluto. Para evaluar la cuantificación, se debe ver la ecuación en el artículo sobre el equilibrio de solubilidad. Para cristales altamente defectuosos en su estructura, la solubilidad puede aumentar con el aumento del grado de desorden. Ambos efectos se producen debido a la dependencia de la solubilidad constante frente a la denominada energía libre de Gibbs asociada con el cristal. Los dos últimos efectos, aunque a menudo difíciles de medir, son de relevante importancia en la práctica [cita requerida] pues proporcionan la fuerza motriz para determinar su 'grado de precipitación' ya que el tamaño de cristal crece de forma espontánea con el tiempo.
Temperatura
La solubilidad de un soluto en un determinado disolvente principalmente depende de la temperatura. Para muchos sólidos disueltos en el agua líquida, la solubilidad aumenta con la temperatura hasta 100 °C.[2] , aunque existen casos que presentan un comportamiento inverso. En el agua líquida a altas temperaturas la solubilidad de los solutos iónicos tiende a disminuir debido a la cambio de las propiedades y la estructura del agua líquida, el reducir los resultados de la constante dieléctrica de un disolvente menos polar.
Los solutos gaseosos muestran un comportamiento más complejo con la temperatura. Como se eleva la temperatura, los gases generalmente se vuelven menos solubles en agua (el mínimo que está por debajo de 120 ° C para la mayoría de gases),[3] pero más solubles en disolventes orgánicos.[2]
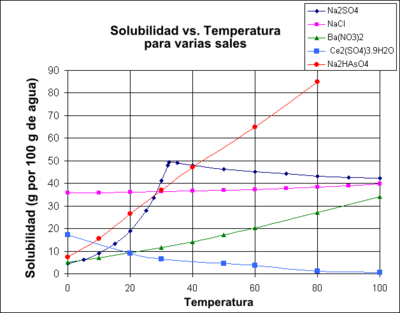
El gráfico muestra las curvas de solubilidad de algunas sales sólidas inorgánicas típicas.[4] Muchas sales se comportan como nitrato de bario y el arseniato de hidrógeno disódico, y muestran un gran aumento de la solubilidad con la temperatura. Algunos solutos (por ejemplo, NaCl en agua) exhiben una solubilidad bastante independiente de la temperatura. Unos pocos, como el sulfato de cerio (III), se vuelven menos solubles en agua a medida que aumenta la temperatura. Esta dependencia de la temperatura se refiere a veces como "retrógrada" o "solubilidad inversa". En ocasiones, se observa un patrón más complejo, como con sulfato de sodio, donde el cristal decahidrato menos soluble pierde agua de cristalización a 32 ° C para formar una fase anhidra más solubles. [cita requerida]
La solubilidad de los compuestos orgánicos casi siempre aumenta con la temperatura. La técnica de la recristalización, utilizado para la purificación de sólidos, depende de un soluto de diferentes solubilidades en un disolvente caliente y fría. Existen algunas excepciones, tales como determinadas ciclodextrinas.[5]
Véase también
- Producto de solubilidad
- Soluto
- Solvente
- Concentración
Referencias
- ↑ I.Y. Nekrasov, "Geochemistry, Mineralogy and Genesis of Gold Deposits", Taylor & Francis, 1996, p.135-136 Books.Google.com.
- ↑ a b John W. Hill, Ralph H. Petrucci, General Chemistry, 2nd edition, Prentice Hall, 1999.
- ↑ P. Cohen (editor), "The ASME handbook on Water Technology for Thermal Power Systems", The American Society of Mechanical Engineers, 1989, page 442.
- ↑ Se han tomado datos del Handbook of Chemistry and Physics, 27th edition, Chemical Rubber Publishing Co., Cleveland, Ohio, 1943.
- ↑ Salvatore Filippone, Frank Heimanna and André Rassat (2002). «A highly water-soluble 2+1 b-cyclodextrin–fullerene conjugate». Chem. Commun. 2002: pp. 1508–1509. doi:.
Enlaces externos
Categoría:- Propiedades químicas
Wikimedia foundation. 2010.