- Hélice superenrollada
-
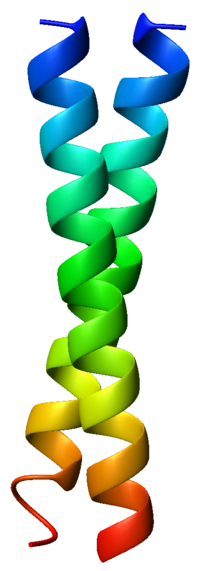 Un ejemplo hélice superenrollada es la cremallera de leucina GCN4 (código PDB 1zik), que es un homodímero paralelo antihorario.
Un ejemplo hélice superenrollada es la cremallera de leucina GCN4 (código PDB 1zik), que es un homodímero paralelo antihorario.
Una hélice superenrollada es un motivo estructural de proteínas, en donde 2 a 7 hélices alfa[1] se enrollan juntas, siendo los dímeros y los trímeros las formas más comunes. Muchas proteínas tipo hélice superenrollada están involucradas en importantes funciones biológicas tales como la regulación de la expresión génica, tales como los factores de transcripción. Ejemplos notables son las oncoproteínas c-fos y jun, y la proteína muscular tropomiosina.
Contenido
Historia
La posibilidad de un motivo estructural de hélice superenrollada fue propuesto para la α-queratina por Francis Crick en 1952, así como el desarrollo de los métodos matemáticos necesarios para determinar su estructura.[2] Esto sucedió poco tiempo después de que la estructura de la hélice alfa fuera propuesta por Linus Pauling et al. en 1951.[3]
Estructura molecular
Las hélices superenrolladas generalmente poseen un patrón repetido, hpphppp, de residuos de aminoácidos hidrofóbicos (h) y polares (p), llamada héptada repetitiva. Las posiciones de la héptada repetitiva están marcadas como abcdefg, donde a y d son las posiciones hidrofóbicas, ocupadas frecuentemente por isoleucina, leucina o valina. Plegar una secuencia con este patrón repetitivo en una estructura secundaria de hélice alfa provoca que los residuos hidrofóbicos se presenten como una "banda" que gira lentamente a lo largo de la hélice en sentido antihorario, formando una estructura anfifática. La forma más favorable para que dos de estas hélices se organicen en el medio acuosos del citoplasma es envolver las zonas hidrófobas entre sí ubicándose los aminoácidos hidrofílicos hacia el exterior.
Debido a esto, el ocultamiento en el interior de las superficies hidrófobicas, proporciona la fuerza termodinámica impulsora para la oligomerización. El ensamblaje en una hélice superenrollada es muy compacto, interaccionando muy íntimamente mediante fuerzas de van der Waals prácticamente todas las cadenas laterales de los residuos d. La compacidad característica de este ensamblaje fue predecida por Francis Crick en 1952[4] y se conoce como ensamblaje "botón en ojal" ("knobs-into-holes" en inglés).
Las hélices alfa pueden ser paralelas o anti-paralelas, y suelen adoptar un enrollamiento en sentido antihorario. Aunque no es tan termodinámicamente tan favorable, se han observado algunos ejemplos en la naturaleza en sentido horario y se han adoptado también en proteínas sintéticas.[5]
Importancia biológica
Un paso clave en la entrada del VIH en las células humanas es la exposición de una hélice superenrollada trimérica paralela conocida como gp41. El trímero de gp41 normalmente se encuentra cubierto por otra glicoproteína de superficie conocida como gp120, la cual lo protege de los anticuerpos. Luego de unirse a la célula blanco, gp120 experimenta un cambio conformacional que expone al trímero gp41, cuya cola hidrofóbica N-terminal atraviesa la membrana celular de la célula destino. Otros tres hélices de gp41 se pliegan en los surcos de la hélice superenrollada del trímero de gp41, formando un hexámero, acercando la cápside viral y la membrana de la célula diana lo suficientemente como para la fusión. El virus ingresa a la célula y comienza a replicarse. Se han desarrollado fármacos inhibidores que se unen en los surcos de gp41 tales como Fuzeon.
Diseño
El problema general de predecir la estructura plegada de una proteína teniendo solamente la secuencia de aminoácidos no está resuelto. Sin embargo, la hélice superenrollada es uno de los pocos motivos de plegamiento para el cual la relación entre la secuencia de aminoácidos y la estructura plegada final ha sido resuelto.[6] Harbury et al. realizaron el estudio del arquetipo de hélice superenrollada, GCN4, en donde establecieron las normas que gobiernan la forma en quela secuencia del peptídica afecta el estado oligomérico (es decir, el número de hélices alfa en el ensamblaje final).[7] [8] El GCN4 es una hélice superenrollada de 31 aminoácidos (lo que equivale a poco más de cuatro héptades) paralela, dimérica y posee una repetición de isoleucinas y leucinas en la posición a y d, respectivamente. Cuando los aminoácidos en las posiciones A y D se intercambian se obtiene un trímero de hélice superenrollada. Además, mutando las posiciones a y d, ambas a leucina dan lugar a la formación de un tetrámero de hélice superenrollada. Estas representan un simple conjunto de normas para la determinación del estado oligomérico de la hélice superenrollada. Otro aspecto del ensamblaje relativamente bien conocido, al menos en el caso de los dímeros, es que colocando un residuo polar (en particular asparagina, N) en posiciones a opuestas fuerza al ensamblaje de hélices paralelas. Este efecto se debe a un enlace de hidrógeno autocomplementario entre estos residuos, el cual quedaría insatisfecho si una asparagina se enlazara con una leucina de la otra hélice.[9]
Referencias
- ↑ Liu, J; Zheng Q, Deng Y, Cheng CS, Kallenbach NR, and Lu M. (2006). «A seven-helix coiled coil». PNAS 103: pp. 15457–62–15462. doi:. PMID 17030805.
- ↑ Crick, F. H. C. (1952). «Is α-Keratin a Coiled Coil?». Nature 170 (4334): pp. 882–883. doi:.
- ↑ Pauling, Linus; Corey, Robert B.; Branson, H. R. (1951). «The Structure of Proteins: Two Hydrogen-Bonded Helical Configurations of the Polypeptide Chain». PNAS 37 (4): pp. 205–211. doi:. PMID 14816373. http://www.pnas.org/content/37/4/205.full.pdf+html.
- ↑ Crick, F. H. C. (1952). «Is α-Keratin a Coiled Coil?». Nature 170 (4334): pp. 882–883. doi:.
- ↑ Harbury, PB; Plecs JJ, Tidor B, Alber T and Kim PS. (1998). «High-Resolution Protein Design with Backbone Freedom». Science 282: pp. 1462–1467. doi:. PMID 9822371.
- ↑ Bromley, E. H. C. (2008). «Peptide and Protein Building Blocks for Synthetic Biology: From Programming Biomolecules to Self-Organized Biomolecular Systems». ACS Chem. Biol. 3 (1): pp. 38-50.
- ↑ Harbury, P. B. (1993). «A switch between 2-stranded, 3-stranded and 4-stranded coiled coils in GCN4 leucine-zipper mutants». Science 262: pp. 1401-1407. doi:.
- ↑ Harbury, P. B. (1994). «Crystal-structure of an isoleucine-zipper trimer». Nature 371: pp. 80-83. doi:.
- ↑ Woolfson, D. N. (2005). «The design of coiled-coil structures and assemblies». Adv. Protein. Chem. 70: pp. 79-112.
Bibliografía
- Crick FHC. (1953) "The Packing of α-Helices: Simple Coiled-Coils", Acta Cryst., 6, 689-697.
- Nishikawa K. and Scheraga HA. (1976) "Geometrical Criteria for Formation of Coiled-Coil Structures of Polypeptide Chains", Macromolecules, 9, 395-407.
- Harbury PB, Zhang T, Kim PS and Alber T. (1993) "A Switch Between Two-, Three-, and Four-Stranded Coiled Coils in GCN4 Leucine Zipper Mutants", Science, 262, 1401-1407.
- Gonzalez L, Plecs JJ and Alber T. (1996) "An engineered allosteric switch in leucine-zipper oligomerization", Nature Structural Biology, 3, 510-515.
- Harbury PB, Plecs JJ, Tidor B, Alber T and Kim PS. (1998) "High-Resolution Protein Design with Backbone Freedom", Science, 282, 1462-1467.
- Yu YB. (2002) "Coiled-coils: stability, specificity, and drug delivery potential", Adv. Drug Deliv. Rev., 54, 1113-1129.
- Burkhard P, Ivaninskii S and Lustig A. (2002) "Improving Coiled-coil Stability by Optimizing Ionic Interactions", Journal of Molecular Biology, 318, 901-910.
- Gillingham AK and Munro S. (2003) "Long coiled-coil proteins and membrane traffic.", Biochim. Biophys. Acta, 1641, 71-85.
- Mason JM and Arndt KM, (2004) "Coiled coil domains: stability, specificity, and biological implications", Chembiochem, 5, 170-6.
Wikimedia foundation. 2010.
