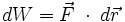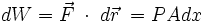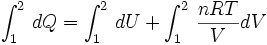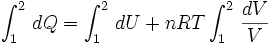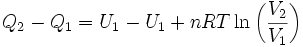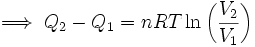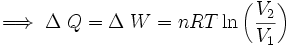- Expansión isotérmica
-
Expansión isotérmica
Una expansión isotérmica es un proceso en el cual una gas se expande (o contrae), manteniendo la temperatura constante durante dicho proceso, es decir que T1 = T2 para los estados inicial (1) y final (2) del proceso isotérmico. Aplicando el primer principio de la termodinámica se obtiene:
- dQ = dU + dW
Entonces integrando la expresión anterior, tomando como estado inicial el estado 1 y estado final el estado 2, se obtiene: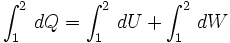 ..........(1)
..........(1)
Por la definición de trabajo dada en mecánica se tiene que:Pero la fuerza
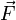 se puede expresar en función de la presión que se ejerce el gas, y el desplazamiento
se puede expresar en función de la presión que se ejerce el gas, y el desplazamiento 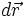 se puede escribir como dx, entonces:
se puede escribir como dx, entonces:Pero Adx equivale a dV, el aumento en el volumen del gas durante esta pequeña expansión, entonces el trabajo efectuado por el gas sobre los alrededores como resultado de la expansión es:
- dW = PAdx = PdV ..........(2)
Ahora reemplazando (1) en (2) se puede integrar:
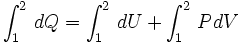 ..........(3)
..........(3)
Pero para integrar la tercera integral, es necesario conocer la forma de variación de la presión P con el volumen, durante el proceso tratado.
En el caso de tratar con gases ideales, se tendría la relación:
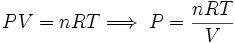 ..........(4)
..........(4)
Por lo tanto reemplazando (4) en (3) se tiene que:
Como los valores n y R son constantes para cada gas ideal, y en este caso la temperatura también es constante, éstas pueden salir fuera de la integral obteniéndose:
Ahora integrando:
![[Q]_1^2 = [U]_1^2 + nRT[\ln V]_1^2](/pictures/eswiki/57/9bb7def5b45c1c793290a37d2aafc98d.png)
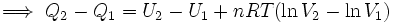
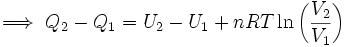 ..........(5)
..........(5)
Pero se sabe que la energía interna depende sólo de la temperatura (Ver: La energía interna como función de la temperatura), y como en este proceso ésta se mantiene constante, no hay cambio en la energía interna del gas, por lo que la expresión (5) se reduce a:
Por lo tanto, en una expansión isotérmica de un gas perfecto, el calor de entrada es igual al trabajo efectuado por el gas.
Véase también
Categoría: Procesos termodinámicos
Wikimedia foundation. 2010.