- Ácido lipoico
-
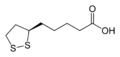
El ácido lipoico es un derivado del ácido graso octanoico. Se halla unido covalentemente a un resto específico de lisina del enzima con quien colabora; en tal caso se acostumbra a llamar lipoamida. La forma oxidada es un disulfuro cíclico y la forma reducida posee dos grupos sulfhidrilo (–SH) (ácido dihidrolipoico).El LA aparece físicamente como un sólido de color amarillo y en su estructura contiene un terminal carboxílico y un anillo ditional.
GENERAL ÁCIDO LIPOICO Nombre sistemático de la UIPAC Ácido (R)-S-(1,2-ditiolan-3-II) pentanoico Otros nombres alfa-ácido lipoico, ácido tiocítico, ácido 6,8-ditioctanoico IDENTIFICADORES Número CAS 1200-22-2 PubChem 6112 ChemSpider 5886 MesH Lipoic+acid PROPIEDADES Fórmula molecular C8H14O2S2 Masa molar 206,33 g/mol Apariencia Cristales amarillos en forma de aguja Solubilidad en agua Soluble en etanol y la sal de sodio es soluble en agua FARMACOLOGÍA Biodisponiblidad 30% vía oral Componentes relacionados Lipoamida y ácido asparagúsico Contenido
Introducción
El ácido lipoico (LA) es un compuesto organosulfurado derivado del ácido caprílico. Contiene dos átomos de azufre (en el carbono 6 y en el carbono 8) unidos mediante un puente disulfuro y, por tanto, está considerado como un oxidante (aunque el átomo de azufre puede existir en estados de oxidación altos). El átomo de carbono 6 es quiral y la molécula existe como dos enantiómeros por separado: R-(+)-ácido lipoico (RLA) y S-(-)-ácido lipoico (SLA) y como una mezcla racémica de los dos enantiómeros: R/S-ácido lipoico. Sólo el enantiómero RLA existe en la naturaleza y es un cofactor esencial de cuatro complejos enzimáticos mitocondriales. El RLA y R/S-LA están disponibles en suplementos nutricionales y han sido utilizados nutricional y clínicamente para enfermedades y diversas condiciones.
La relación entre el RLA sintetizado endógenamente (por un puente enzimático) y el administrado sin RLA o R/S-LA no ha estado caracterizada pero los niveles de plasma libre y de células incrementan rápidamente después de su consumición oral o inyección intravenosa. El lipoato es la base conjugada del ácido lipoico, y la forma más prevalente de LA en condiciones fisiológicas. Aunque en el medio intracelular se esté reduciendo, tanto el LA libre como su forma reducida, el ácido dihidrolipoico (DLHA), han sido detectados en las células después de la administración de LA. La mayoría del RLA producido endógenamente no está libre, porque el ácido octanoico, el precursor del RLA, está unido a complejos enzimáticos, antes de la inserción enzimática de los átomos de azufre. Como un cofactor, el RLA está unido covalentemente mediante un puente amida a un terminal lisina, residuo de los dominios liposos. Uno de los roles más estudiados del RLA como cofactor en el metabolismo aeróbico es el complejo piruvato deshidrogenasa (PDHC). El R-lipoato endógeno (unido a una enzima) también participa en la transferencia de grupos acil al complejo alfa-keto-glutarata deshidrogenasa (KDHC) y al complejo de oxo-ácido deshidrogenasa de cadena ramificada (BCOADC). El RLA transfiere un grupo metilamina al complejo de escisión de la glicina (GCV). El RLA sirve como un cofactor al complejo acetona deshidrogenada (ADC) catalizando la conversión de acetona (3-hidroxi-2-butanona) a acetaldehido y a acetil-coA, en algunas bacterias, permite que la acetona sea usada como la única fuente de carbono.
El RLA es esencial para la vida y para el metabolismo aeróbico. El SLA es artificial y un subproducto resultado de procesos de fabricación aquiral. El SLA está considerado seguro y no tóxico generalmente, excepto en casos de deficiencia de tiamina, en los cuales su presencia como el enantiómero aislado o formando el 50% de la mezcla racémica, ha sido fatal testado en ratas. El RLA es esencial para el metabolismo y para todas las formas de vida desde que la mitocondria se fusionó con las células primitivas hace, como mínimo, un billón de años. El SLA y el R/S-LA no existían antes de la síntesis química ideada en 1952. Gracias al bajo coste y a la facilidad de producir R/S-LA respecto al RLA, la forma racémica fue mucho más usada clínicamente en Europa y Japón desde los años cincuenta a los sesenta, a pesar del rápido reconocimiento de que las distintas formas del RLA no eran equivalentes biológicamente. Las primeras técnicas para sintetizar RLA y SLA no aparecieron hasta mediados de los años cincuenta.
El RS-LA fue aprobado para el tratamiento de la diabetes en Alemania en el año 1966. el RS-LA fabricado en Japón y Alemania se dispuso como un suplemento nutricional en Estados Unidos a finales de la década de los ochenta, pero su interés y uso aumentó de forma exponencial después de que el Profesor Lester Parker lo presentara como el “milagro antioxidante” en un episodio del ABC Nightline en 1999. Los avances en la química quiral condujeron a el descubrimiento de más tecnologías eficientes para la producción de enantiómeros aislados de dos formas: por la resolución clásica y por la síntesis asimétrica, y la demanda de RLA también se incrementó durante ese período. En el siglo XXI, el R/S-LA, el RLA y el SLA altamente puros química y/u ópticamente están disponibles en cantidades industriales. Hoy en día, la mayoría del suministro de R/S-LA y RLA se fabrica en China y en cantidades menores en Italia, Alemania y Japón. El RLA se produce mediante modificaciones de un proceso que fue descrito primero por Georg Land en su tesis doctoral y más tarde patentada por DeGussa.
Aunque el RLA es el favorito nutricionalmente debido a su función similar a las vitaminas en el metabolismo, tanto el RLA como el R/S-LA son muy utilizados como suplementos nutricionales. Las dos reacciones, la estereotípica y la no-estereotípica, son conocidas por ocurrir in vivo y por contribuir a los mecanismos de acción, pero las pruebas realizadas hasta la fecha indican que el RLA podría ser el eutómero (la forma preferida nutricional y terapéuticamente).
Todas las formas disulfuras del LA (RLA, R/S-LA y SLA) pueden ser reducidas a DHLA aunque tanto la reducción del tejido específico como del estereoselctivo (preferencia por un enantiómero, más que el otro) han sido descritas en sistemas modelo. Al menos dos enzimas citosólicas: la glutanión reductasa (GR) y la tiorredoxina reductasa (Trx1) y dos enzimas mitocondriales: la lipoamida deshidrogenasa y la tiorredoxina reductasa (Trx2) reducen LA. El SLA es reducido estereoselectivamente por enzimas citosólicas GR, mientras que Trx1, Trx2 y la lipoamida deshidrogenasa reducen estereoselectivamente RLA. El ácido R-(+)-lipoico está enzimática o químicamente reducido a ácido R-(-)-dihidrolipoico. El ácido dihidrolipoico (DHLA) también puede formar intracelular y extracelularmente reacciones de intercambio de tilo-sulfuro, mediante vias no enzimáticas.
El estado redox citosólico y mitocondrial se mantiene en un estado reducido relativo a la matriz extracelular y al plasma debido a las altas concentraciones de glutatión. A pesar de la fuente reducción del entorno, el LA ha sido detectado intracelularmente en las dos formas: oxidado y reducido. El LA libre es metabolizado rápidamente en una variedad de cadenas más cortas de metabolitos (via β-oxidación o mono/bimetilación) que han sido identificadas y cuantificadas intracelularmente, en el plasma y en la orina.
Pese haberse afirmado que el RLA libre (sin enzima unida) no ha sido detectado en humanos, los niveles de referencia (previos a la suplementación) de RLA y de R-DHLA han sido detectados en niveles bajos en el plasma humano. El RLA ha sido detectado en 12’3 – 43’1 ng/l siguiendo a la hidrólisis del ácido. La hidrólisis enzimática libera entre 1’4 – 11’6 ng/l y entre 1 – 38’2 ng/l, utilizando subtilisina y alcalasa, respectivamente. No se ha determinado si la pre-suplementación de los niveles de RLA deriva de las fuentes de alimentos, del volumen de actividad mitocondrial o de los microbios del intestino, pero los niveles bajos se han correlacionado con una gran variedad de estados de las enfermedades.
Las enzimas proteolíticas rompen los residuos de R-lipolisina de los complejos enzimáticos mitocondriales, derivados de los alimentos. Éstas son incapaces de romper el enlace amida del ácido R-lipoico-lisina. Tanto la lipoamida sintética como la R-lipo-L-lisina son degradadas rápidamente por un sérum de lipoamidasas que liberan ácido R-lipoico y L-lisina o amoníaco en el corriente sanguíneo. Recientemente, se ha cuestionado si las fuentes de alimentos de RLA proporcionan algún beneficio mesurable a nivel nutricional o terapéutico, debido a las bajas concentraciones. El lipoato es la base conjugada del ácido lipoico y es una de las sustancias más prevalentes bajo condiciones fisiológicas. La mayoría del RLA endógeno no está libre porque el octanoato está unido a los complejos enzimáticos que usan la vía LipA. Los átomos de azufre derivan del aminoácido L-cisteína y se unen asimétricamente al octanoato mediante lipoato sintasas y, por lo tanto, generan un centro quiral en C6. El RLA endógeno ha sido encontrado fuera de la mitocondria, asociado con el núcleo, peroxisomas y otros orgánulos. Se ha sugerido que la forma reducida, R-DHLA, puede ser el sustrato de la prostaglandina E-2 sintasa asociada a la membrana.
Como un cofactor, el RLA está unido covalentemente mediante un enlace amida a un termina lisina, residuo de varios dominios liposos. El papel mejor estudiado del RLA endógeno es cuando actúa como un cofactor en el metabolismo aeróbico, concretamente en el complejo piruvato deshidrogenasa (PDH) que contiene 3 subunidades: E1, E2 y E3. En E1, el piruvato se oxida en acetato y en dióxido de carbono. En E2, en la forma reducida, R-DHLA, el grupo acetil se transfiere a la coenzimaA, obteniendo acetilCoA. En E3, el R-DHLA se reoxida en RLA, generando NADH. El lipoato también participa en la transferencia de grupos acil en otras dos 2-oxoácido-deshidrogenasas mitocondriales: el complejo α-cetoglutarata deshidrogenasa (KGDH) y la cadena ramificada del complejo oxo-ácido deshidrogenasa (BCDH). Además de las reacciones de transferencia de grupos acil, el RLA también transfiere un grupo metilamina a los complejos de escisión de la glicina.
Historia
RLA, antes de su aislamiento y caracterización, también era conocido como protogén A, factor reemplazante del acetato y oxidante del piruvato (POF). Esto fue debido a la observación de que factores esenciales del crecimiento (posteriormente identificados como RLA) eran necesarios en el enterococco y otros microorganismos para descarbonatar piruvato en acetato mediante oxidación. Estos organismos carecían de la habilidad para sintetizar R-lipoato, de manera que necesitaban obtenerlo del ambiente. Dextro-(+)-LA (~30 mg) fue aislado en forma cristalina por Lester Reed en 1951 de ~10 toneladas de hígado de vacuno. La descripción de los cristales amarillos se llevó a cabo con la colaboración de Gunsalus, Reed y químicos en Eli Lilly, quienes probaron que el aislamiento natural contenía una cadena alipática de ocho carbonos, dos átomos de sulfuro (uno de los cuales era terminal), y que era acídica mediante la polarimetría de dextro-(+)-configuración. Antes de completar su identidad estructural y descripción, se propuso que los isómeros de su forma natural pudieran haber sido diseñados de acuerdo con el átomo de carbono de la cadena del ácido octanoico que estaba unido al átomo secundario de azufre. Originariamente, 4, 5 o 6-ácidos tiócticos eran posibles candidatos de la estructura correcta del RLA, dependiendo de la unión del azufre al C4, C5 o C6, respectivamente. La síntesis del compuesto racémico (R/S)-LA en 1952, demostró la afirmación de 6-ácido tióctico había resultado correcta. El nombre trivial de “α-ácido lipoico” fue propuesto por Reed (y subsecuentemente aceptado) debido a su lipofilicidad (amante del lípido) calidad y por el hecho de ser un ácido carboxílico[69]]. Reed designó al nuevamente aislado componente “alfa“ con el propósito de diferenciarlo de un segundo compuesto aislado y oxidado al que llamó “β-ácido lipoico”. La configuración de la forma natural fue propuesta en 1955 en comparación con el diagrama del punto de fusión del ácido R-(+)-3-metiloctano con ácidos (+) y (-)- 3-mercapto octanodioico, pero no se demostró que contuviese la configuración R-absoluta (haciendo uso de las normas de prioridad de Cahn-Ingold-Prelog) hasta 1983 cuando fue sintetizado del ácido S-málico. Los primeros perfiles de animal farmacoquinético de R/S-LA fueron presentados de la mano de Profesor Leonardo Donatelli en el “International Symposium on Thioctic Acid” celebrado en Nápoles (1955), quién a su vez presentó una impresionante y potente lista de efectos antitóxicos de LA contra una amplia variedad de toxinas químicas. Esta conferencia promovió el interés del mundo por descubrir nuevas aplicaciones de LA a parte de su uso como sustancia “vitamine-like“ (similar a una vitamina). Estudios posteriores en Europa y Japón aumentaron y expandieron el número de aplicaciones clínicas, al igual que el número de toxinas químicas que LA combatía, incluyendo radiaciones. Los efectos radio-protectores del LA desencadenaron una importante labor de investigación como un potente antídoto para escapes nucleares y envenenamientos radiactivos en Japón, Estados Unidos, Alemania, Italia y en la Unión Soviética después de la Segunda Guerra Mundial. Tiempo después, también se demostraron sus beneficios en el trato de las víctimas del desastre de Chernobyl. Se publicaron diversos informes en Europa acerca del uso del LA en el tratamiento del veneno de la amanita. La industria farmacéutica creció en Japón tras la Segunda Guerra mundial, y con ello el ácido tiotico (LA) fue desarrollado como un compuesto de la salud por muchas firmas japonesas, incluyendo Takeda, Yamanouchi, Fujisawa, Daiichi Seikaku y Rotho, quienes también manipularon vitaminas-B y otros compuestos mediante enlaces covalentes entre tiamina y LA. Durante los años cincuenta, y ya entrados los sesenta, LA fue activamente investigada y/o bajo desarrollo comercial por The Research Foundation of New York, Eli Lilly Corporation” Merck, Sharpe & Dohme, Dupont y por American Cyanamid-Lederle Laboratories en los Estados Unidos. Además, fueron proporcionados una gran suma de patentes para nuevos métodos de aplicación.
Había un gran interés por utilizar LA en desórdenes involucrados en insuficiencia de energía. Los primeros ensayos clínicos del LA en los Estados Unidos fueron dirigidos por Fredrick C. Bartter, Burton M. Berkson y otros asociados del Instituto Nacional de Salud (NIH) en los años setenta.
Los doctores Bartter y Berkson suministraron LA vía intravenosa en varios centros médicos estadounidenses a 79 personas con dolor severo de hígado, de las cuales 75 recobraron el bienestar. Así pues, ambos médicos fueron designados por la FDA como principales investigadores de este agente terapéutico como fármaco en investigación. El Dr. Berkson continuó utilizándolo exitosamente en el tratamiento de enfermedades hepáticas crónicas (hepatitis viral, hepatitis autoinmune, etc). La razón original de uso del ácido R/S-lipoico (LA) como suplemento nutricional y terapéutico era su comportamiento semejante al de la vitamina B, actuando como sustrato o cofactor esencial de la actividad enzimática. Se llegó a dicha conclusión porque concentraciones menores de RLA fueron halladas en tejidos humanos con varias enfermedades. Se creía, pues, que dicha suplementación restauraría los niveles normales permitiendo de esta manera recobrar la salud y que SLA era esencialmente una sustancia inerte. SLA era considerada una sustancia no bioactiva y que existía en in vivo como un isómero de lastre a mediados de los años cincuenta, desde que los ensayos microbianos que solían cuantificar LA eran casi completamente esteroespecíficos para RLA.
Se observó que no era cierto con un modelo animal cuando se demostró la toxicidad selectiva para ambos, R/S-LA y SLA, en ratas con déficit de tiamina. RLA por si solo no era tóxico. Este estudio corroboró el primer caso de inhibición competitiva de SLA con respecto al descubrimiento del RLA como componente del 50% de la mezcla racímica, lo cual tuvo cierta relevancia en la deficiencia de tiamina en humanos.
En un segundo caso, ante los efectos de una antitoxina esteroespecífica, solamente RLA era capaz de invertir la toxicidad selectiva de un veneno arsénico en el corazón de la mitocondria. Se cree que los efectos esteroespecíficos antitoxínicos del RLA suceden debido a la activación del factor del transcripción Nrf2 en respusta al estrés, el cual activa la batería de genes citoprotectivos por medio del elemento de respuesta antioxidante e induce las enzimas de detoxificación de segunda fase, de tal manera que que impulsa el carácter antioxidante de la célula. RLA in vivo es mejor etiquetdo como un modulador redox esteroespecífico (desde que Nrf2 es controlado por redox ) o como un agente citoprotector esteroespecífico más que un antioxidante (i.e. “basurero” directo de radicales libres). Esta afirmación es reforzada por el hecho de que incluso dosis altas de RLA conllevan reducir concentraciones micromolares intracelulares, mientras que el glutanón y el ácido ascórbico, los principales amortiguadores redox, son presentes en concentraciones milimolares.
Biosíntesis y enlaces
El precursor del ácido lipoico (ácido octanoico), se forma mediante la biosíntesis de ácidos grasos o por medio de la β-oxidación de una larga cadena de ácidos grasos. En las células eucariotas existe una segunda vía de biosíntesis de ácidos grasos en las mitocondrias para uso propio. El octanoato es transferido de un tioester de acilo portador de una proteína, a una amida de dominio lipoil por una octanoiltransferasa. Los centros de azufre están insertados el sexto y octavo carbono de un octano gracias a un mecanismo en el radical s-adenosil metionina por la síntesis de lipoil. Los sulfuros proceden del polipéptido lipoil sintasa. Como consecuencia, el ácido lipoico es sintetizado en el dominio lipoil y no se produce ácido lipoico libre. El ácido lipoico puede ser regenerado en cualquier momento en que las proteínas son degradas por la actividad de un enzima específico, llamado lipoamidasa. El lipoico libre puede ser unido al dominio lipoil mediante una enzima proteína lipoica ligasa. La acción de la ligasa de esta enzima necesita ATP. Esta enzima actúa por medio de un de puente intermediario de lipoil-adenilato.
Complejos dependientes del ácido lipoico
2-OADH reacciones de transferencia se producen por un mecanismo similar en el complejo PDH, 2-oxoglutarato deshidrogenasa (OGDH), en el complejo oxoácido deshidrogenasa de cadena ramificada (BCDH), y en el complejo acetoína deshidrogenasa (ADH).
El más estudiado de estos es el complejo PDH. Estos complejos tienen subunidades centrales: E1-3, los cuales son descarboxilados, lipoil transferasa y dihidrolipoamina deshidrogenasa, respectivamente. Estos complejos tienen un núcleo central E2 y otras subunidades alrededor de dicho núcleo, formando así el complejo. En el espacio intermedio entre estas dos subunidades, el dominio lipoil conduce intermediarios entre estos dos focos activos. La geometría del núcleo PDH E2 es cúbica en bacterias Gramo negegativo o dodecaédrica en eucarotas y en bacteias de Gramo positivo. Curiosamente la gemotría del 2-OGDH y del BCDH es siempre cúbica. El dominio lipoil por si solo está unido flexiblemente al núcleo E2 y el número de dominios lipoil varía de uno a tres para un determinado organismo. El número de estos dominios ha sido sometido a experimentos variados y parece tener pocos efectos en el crecimiento desde que se añaden nueve, pese a que más de tres disminuyen la actividad del complejo. Los dominios lipoil dentro de un complejo dado son homogéneos, y al menos existen dos grandes agrupaciones de dominios lipoil en la secuencia de un organismo.
El sistema de escisión de la glicerina es diferente al de otros complejos y tiene una nomenclatura distinta. En este complejo la proteína H es un dominio lipoil libre con hélices adicionales, la proteína L es una dihidrolipoamida deshidrogenasa, la proteína P es una descarboxilasa y la proteína T transfiere metilamina del lipoato al tetrahidrofolato (THF), cediendo así metilina-THF y amonio. La metilina-THF es entonces utilizada para sintetizar serina a partir de glicerina. Este mecanismo se utiliza en muchos otros organismos y tiene un papel crucial en el ciclo fotosintético del carbono.
Fuentes biológicas
El ácido lipoico se encuentra en casi todas las comidas, pero especialmente en el hígado, el corazón, el riñón, las espinacas, el brocoli y en extracto de levadura. En su estado natural, el ácido lipoico mantiene un enlace covalente y no está directamente disponible en las fuentes de la dieta. Además, la cantidad de ácido lipoico actual es muy baja. Por ejemplo: la purificación del ácido lipoico para determinar su estructura requiere de aproximadamente 10 toneladas de residuos de hígado, donde tan sólo yacen 30mg.Por consiguiente, todo el ácido lipoico disponible como suplemento es químicamente sintetizado.
Uso del ácido lipoico como suplemento dietético
El uso nutricional y clínico del acido lipoico ha sido reconocido y potenciado comercialmente desde mediados de los años cincuenta. El RLA es un clásico ejemplo de un nutriente ortomolecular, tal como dijo Linus Pauling. En Europa y en Japón, debido al bajo coste y la facilidad de fabricar R/S-LA (relacionado con el RLA), así como los tempranos éxitos en tratamientos, la forma racémica fue más ampliamente utilizada (nutricional y clínicamente) a pesar de que se supo poco después que las diversas formas del ácido lipoico no eran bioequivalentes. La razón original por la que usaron el ácido lipoico R/S como suplemento nutricional fue que el endógeno RLA tenía propiedades bioquímicas parecidas a las de la vitamina B (actuando como un substrato o un cofactor esencial para la función enzimática). Se encontró que personas con enfermedades varias tenían bajas concentraciones de endogenos de RLA en su tejido, así como niveles bajos de RLA en la orina. Una simple inyección de 10-25 mg de acido lipoico R/S lograba normalizar la producción de orina al día e incluso mejorar la salud del paciente en muchos sentidos. Cuando se demostró que los mamíferos tienen el gen con la información para sintetizar RLA, éste perdió popularidad como suplemento vitamínico, pero hoy es considerado como un “nutriente esencial”. El mecanismo exacto que explique cómo los niveles de RLA disminuyen con la edad y en algunas enfermedades progresivas se desconoce. Además, experimentos con microbios usados para cuantificar el ácido lipoico eran esencialmente estereoespecíficos para RLA (100% activos para RLA, 0% de actividad para SLA), así que se empezó a creer que SLA era prácticamente interte o de muy poca actividad biologica. Sin embargo, fue desmentido por Gal, que demostró la toxicidad estereoespecífica del S (enantiomero de tiamina) deficiente en ratas.
En 1959 se reconoció el potencial antioxidante del ácido lipoico y se empezó a usar como conservante para manteca de cerdo y aceites de cocina. Sin embargo, faltarían otros 40 años para que ganara una popularidad significante y se aplicara para mantener o mejorar la salud humana. A principios de los años sesenta Fujisawa Pharmaceuticals y Takeda Pharmaceuticals empezaron a comercializar internacionalmente el ácido lipoico R/S como droga y como nutriente y bajo el nombre comercial de Tioctan y Biletan. En Italia, Carlo Erba SpA (Milan) y Farmachimica Cutolo-Calosi (Nápoles) fueron dos de las primeras compañías en comercializar y desarrollar el acido lipoico R/S-thioctamide y R/S-dihydrothioctamide.
A mediados de los sesenta Chemiewerk Homburg, en Frankfurt, Alemania (renombrado como Asta Medica en 1985 y la división farmacéutica de Degussa) comenzaron a suministrar ácido lipoico R/S bajo el nombre Thioctacid en el mercado europeo (la materia prima provenía de Carlo Erba SpA). A final de los años ochenta, Heinz Ulrich, M.D. de Chemiewerk Homburg reinvestigó experimental y clínicamente las diferencias entre el RLA, el SLA y el RS-LA. Con Ulrich comenzó una nueva era en la investigación moderna sobre el RLA. Ulrich contactó con el profesor Lester Packer de UC Berkeley con el objetivo de fomentar el esfuerzo de futuras investigaciones para elucidar los mecanismos de acción de acido lipoico y para ayudar a expandir internacionalmente sus aplicaciones clínicas y nutricionales.
En los tardíos ochenta, el acido lipoico R/S manufacturado en Japón y Alemania comenzó a estar disponible como suplemento nutricional en los Estados Unidos. El interés en los antioxidantes y los radicales libres creció gracias al reconocimiento del papel del oxigeno y el nitrogeno reactivo en la salud, la enfermedad y el envejecimiento. En consecuencia, las ventas y el uso del acido lipoico R/S crecieron lenta pero constantemente a lo largo de los noventa. El interés y el uso del acido lipoico creció exponencialmente después de que el Dr. Packer lo presentara en un episodio del ABC Nightline en 1999, donde fue aclamado como “el milagro antioxidante”. El acido lipoico, la carnitina o la acetil carnitina fueron recomendados como “suplementos bioenergéticos”. La demanda del RLA junto con el AL R/S creció después de que el grupo de investigación del profesor Bruce Ames (también de Berkeley) encontrara que el RAL y la acetil carnitina invertían los marcadores relacionados con la edad de ratas viejas a niveles juveniles.
Actualmente R/S-LA y RLA están disponibles en forma de cápsulas, tabletas y líquidos acuosos como suplementos nutricionales en los Estados Unidos de venta libre y calificados como antioxidantes. Esta etiqueta ha sido cuestionada recientemente. En Japón, el LA se comercializa como “perdida de peso” y suplemento de “energía”.
No se ha establecido una cantidad diaria recomendada (CDR) ni tampoco se han definido con claridad las relaciones entre la dosis suplementaria y la dosis terapéutica.
Cualquier dosis oral diaria de la gama de RLA o R/S-LA va desde <10 mg en las formulaciones multi-vitamina hasta 600 mg como un producto independiente. Las dosis más altas de hasta 1800 mg se han utilizado terapéuticamente y las dosis tan altas como 4.5 g /día han sido recomendadas para el tratamiento del VIH y el cáncer.
El RLA puede funcionar “in vivo” como una vitamina B y en dosis más altas como alimentos derivados de plantas como la curcumina, sulforafano, el reveratrol y otras sustancias alimenticias que inducen enzimas de fase II de desintoxicación, donde actúan como agentes citoprotectores. Debido a su alta estabilidad y biodisponibilidad (relativa a la forma del ácido libre de RLA), la Universidad de salud y ciencia de Oregon está usadando la sal sódica del ácido R-lipoico (NaRLA) en un ensayo clínico financiado por el gobierno federal para la esclerosis múltiple. Efectos antioxidantes y prooxidantes del ácido lipoico y del ácido dihidrogenolipoico.
Los efectos antioxidantes del acido lipoico fueron demostradas cuando se descubrió que podia usarse como prevención de los síntomas de deficiencia de vitamina C y vitamina E. El acido lipoico es reducido intracelularmente en acido dihidrogenolipoico seguido de la reducción los radicales antioxidantes de la vitamina C y vitamina E[169]. El AL es capaz de eliminar el oxigeno reactivo y el nitrogeno reactivo in vitro después de una larga incubación. Sin embargo, hay pequeñas evidencias de que lo mismo ocurre in vivo o que la eliminación de los radicales contribuye al mecanismo primario de acción del AL. La relativa eficiencia del AL en la actividad de eliminación del acido hipocloroso (un bactericida producido por neutrófilos que pueden producir inflamacion y daño de tejido) se debe a la conformación estable del anillo 5- dithiolane, que se pierde con la reducción de DHLA. En las células, el AL es reducido a acido dihidrogenolipoico, que es considerado como la forma más bioactiva del AL y la responsable de la mayoria de sus efectos antioxidantes. Esta teoria ha sido rechazada debido al elevado nivel de reactividad de los dos sulfihidrilos libres, la baja concentración intracelular del DHLA y la rápida metabolización de uno de los dos sulfihidrilos. Pese a que el DHLA y el AL han sido encontrados dentro de las células después de la administración, la gran parte del DHLA intracelular existe probablemente como disulfuros mixtos con varios residuos de cisteina de proteínas mitocondriales y citosolicas. Descubrimientos recientes sugieren efectos terapeuticos y rejuvenecedores gracias a la modificación de las señales de transducción y transcripción genética, mejorando el estado antioxidante de la célula. Paradójicamente, este hecho se produce probablemente mediante mecanismos pro-oxidantes, no mediante la eliminación de los radicales o efectos reductores.
Usos terapéuticos del ácido lipoico
La posibilidad de un estado de deficiencia del RLA (enantiómero-R del ácido lipoico) fue propuesta por primera vez por Franz Rausch M.D. en la conferencia internacional sobre el ácido tióctico (1955) en la cual se presentaron datos clínicos que revelaban que los pacientes que sufren varias enfermedades, medicados con dosis altas (25-50 mg/día) de LA intravenoso, no sufen efectos secundarios. Rausch afirmó que los pacientes en coma hepático fueron reanimados con LA intravenoso. El doctor Colarusso confirmó las hipótesis de Rausch. Un investigador italiano, Umberto Buttturini (Universidad de Bolonia) realizó preliminarmente, observaciones clínicas y experimentales con LA en humanos. Butirina descubrió un efecto "anti- esteatogénico" moderado de ácido tióctico, que también dió una justa protección contra la toxicidad del tetracloruro de carbono. El ácido lipoico restauró el glucógeno del hígado y el contenido de sulfhidrilo en condiciones patológicas y hepato-fisiológicas experimentales, pero no fue efectivo en el tratamiento de la "cirrosis portal" o la diabetes inducida por aloxano. Posteriormente, Cutolo y Reduzzi (Laboratorio Ricerche, del Instituto Sueroterápico italiano, Nápoles) confirmaron satisfactoriamente poder tratar la diabetes inducida por aloxano. El Doctor P.Introzzi (Universidad de Pavía) presentó las historias clínicas de cuatro casos de cirrosis hepática, dos de insuficiencia cardícaca congestiva y dos de la hepatitis crónica. Un caso de cirrosis hepática y los dos de hepatitis crónica respondieron favorablemente.
Después de la conferencia y de los siguientes 10 años, numerosos trabajos, principalmente realizados por médicos italianos, alemanes y japoneses, informaron de una amplia gama de éxitos clínicos y experimentales para afecciones tratables con LA. En unos 15-20 años, las investigaciones clínicas se expandieron por Polonia, Checoslovaquia, Rusia, Francia, Suiza y los Estados Unidos.
El ácido lipoico ha demostrado ser hepatoprotector, mejorar la circulación del hígado, tratar enfermedades crónicas del hígado, tales como la ictericia, la hepatitis, cirrosis, coma hepático, diabetes, alteraciones del metabolismo de los carbohidratos,neuropatía diabética, trastornos metabólicos de la histidina, alteraciones de los niveles de lactato y piruvato, enfermedades psiquiátricas, enfermedad de Botkin, envenenamiento con antimonio, envenenamiento por mercurio, aterosclerosis, aterosclerosis coronaria, enfermedades cerebrovasculares, daño en el hígado por etionina, envenenamiento por cianuro de potasio, intoxicación por estreptomicina, envenenamiento por setas, bajar el colesterol, invertir anestesia barbitúrica, reducir experimentalmente la ingesta voluntaria de alcohol y aumentar la tolerancia de potasio.
El ácido lipoico también ha sido usado experimentalmente y/o clínicamente para prevenir la disfunción de órganos, reducir la disfunción endotelial y mejorar la "albuminuria", para tratar o prevenir la enfermedad cardiovascular, acelerar la cicatrización de heridas crónicas, reducir los niveles de ADMA en los pacientes diabéticos en fase terminal de enfermedad renal en hemodiálisis, síndrome de boca ardiente, reducir la sobrecarga de hierro, tratar síndromes metabólicos, mejorar o prevenir la aparición de la enfermedad cognitiva relacionada con la edad ,prevenir o retardar la progresión del Alzheimer, prevenir la disfunción eréctil ( en modelos animales, anecdóticamente en humanos), prevenir migrañas, tratar la esclerosis múltiple, el tratamiento de enfermedades crónicas relacionadas con el estrés oxidativo, reducir la inflamación, inhibir productos de avanzada glicación final (AGE) y tratar la enfermedad arterial periférica.
Uso como agente quelante
Debido a la presencia de dos grupos tiol, el ácido dihidrolipoico es un agente quelante, es decir, sustancia que forma complejos con iones de metales pesados. La administración del ácido lipoico puede mejorar significativamente la excreción biliar del mercurio inorgánico en los experimentos con ratas, aunque no se sabe si esto se debe a la quelación con ácido lipoico o a algún otro mecanismo(285). El ácido lipoico tiene la capacidad de cruzar la barrera sangre-cerebro en los seres humanos a diferencia del DMSA y DMPS. Sin embargo su eficacia depende en gran medida de la dosis y frecuencia de aplicación.
Evidencias de que el ácido R-lipoico, ácido S-lipoico y ácido R/S lipoico son farmacológicamente distintos.
Únicamente el R-enantiómero (RLA) del ácido lipoico aparece por naturaleza. Teóricamente, el S-enantiómero(SLA) puede contribuir a la reducción del RLA cuando una mezcla racémica(50% R-enantiómero y 50% S-enantiómero) se produce, pero ello es de dudosa relevancia en experimentos "in vivo". Varios estudios han demostrado que el SLA tiene menor actividad que RLA o bien interfiere con los efectos específicos del RLA pon inhibición competitiva.(289-302). Además, si bien una mezcla racémica de LA se ha encontrado para incrementar la expresión de GLUT4, responsable de la captación de glucosa en las células, se ha demostrado que el RLA puede hacerlo mejor que cualquiera de los SLA o R/S-LA. Ello indica que los efectos específicos del RLA pueden ser inhibidos cuando el SLA está presente. Según la página web del instituto Linus Pauling (escrita por el fallecido Jane Higdon, Ph.D y revisada por Tory Hagen Ph.D) prácticamente todos los estudios publicados en los suplementos de LA en los seres humanos (hasta aproximadamente 2006) utilizaron R/S-LA. Desde ese momento, muchos estudios del grupo Hagen han demostrado que, contrariamente a la creencia popular, el ácido lipoico no es principalmente captador de radicales libres " in vivo" sino más bien un inductor de respuesta de estrés beneficioso que, indirectamente, mejora la capacidad antioxidante de la célula (305,306). Esta capacidad es 100% estereoespecífica del enantiómero-R y está mediada por el factor de transcripción de respuesta de estrés,MRF2.
Un reciente estudio humano farmacocinético de RLA demostró que la máxima concentración plasmática (CMAX) y el área bajo la curva (AUC, una medida de biodisponibilidad) es mayor que cualquier otra forma de dosificación cuando se administra en forma de sal y en altos niveles plasmáticos alcanzados por administración intravenosa. Además, los altos niveles de plasma comparables con los de los modelos animales donde el Nrf2 fue activado se lograron. El sodio Nrla (NaRLA) debido a su alta biodisponibilidad, ha sido propuesto para ser la forma superior del ácido lipoico para usos farmacéuticos y ”nutracéuticos”.
Referencias
- Alpha Lipoic Acid (ALA) Descripción general. Deficiencia. Las fuentes de alimentos. Mecanismo de acción. Usos principales. Las dosis comunes. Los posibles efectos secundarios. Hecho frente a ficción.
Categorías:- Coenzimas
- Compuestos organoazufrados
- Ácidos orgánicos
Wikimedia foundation. 2010.