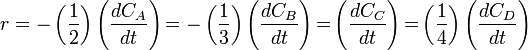- Cinética y mecanismos de reacción
-
Cinética y mecanismos de reacción
En Química, Cinética y Mecanismos de Reacción es una rama de la química física que estudia la velocidad de las reacciones, el catálisis, el mecanismo cinético por el cual las reacciones se llevan a cabo y el estudio matemático de cada ámbito expuesto anteriormente.
Contenido
Cinética de Reacciones
El objeto de la cinética química es medir las velocidades de las reacciones químicas y encontrar ecuaciones que relacionen la velocidad de una reacción con variables experimentales.
Se encuentra experimentalmente que la velocidad de una reacción depende mayormente de la temperatura y las concentraciones de las especies involucradas en la reacción. En las reacciones simples, sólo la concentración de los reactivos afecta la velocidad de reacción, pero en reacciones más complejas la velocidad también puede depender de la concentración de uno o más productos. La presencia de un catalizador también afecta la velocidad de reacción; en este caso puede aumentar su velocidad. Del estudio de la velocidad de una reacción y su dependencia con todos estos factores se puede saber mucho acerca de los pasos en detalle para ir de reactivos a productos. Esto último es el mecanismo de reacción.
Las reacciones se pueden clasificar cinéticamente en homogéneas y heterogéneas. La primera ocurre en una fase y la segunda en más de una fase. La reacción heterogénea depende del área de una superficie ya sea la de las paredes del vaso o de un catalizador sólido. En este capítulo se discuten reacciones homogéneas.
Medidas de la Velocidad de Reacción
Durante una reacción, las concentraciones de las especies cambian con el tiempo. La velocidad de reacción se mide a través de la variación de estas concentraciones en el tiempo de relacion de la variacion quimica respecto al mundo de la ciencia y que describe una parabola en terminos matematicos . Existen dos métodos para medir estas concentraciones.
Método físico
Consiste en la medición de una propiedad que se relacione con la concentración. Esta propiedad debe ser fácil de medir y sensible al cambio de concentración. Puede ser ángulo de rotación de la luz polarizada (para sustancias ópticamente activas), presión o volumen (para reacciones gaseosas), pH, índice de refracción, densidad óptica, RMN, conductividad eléctrica (reacciones entre iones o entre moléculas neutras que produzcan iones), etc. Estas propiedades físicas son generalmente más fáciles de medir que la medición de concentración por métodos químicos (análisis cuantitativo).
Método químico
Si no se pueden utilizar métodos físicos se usarán los químicos, para lo cual deben sacarse muestras (alícuotas) de la mezcla reaccionante cada cierto tiempo y analizar cuantitativamente los reactivos o productos. Para efectuar el análisis químico debe “detenerse” la reacción en la muestra. Para ello existen varios métodos: a) enfriar súbitamente la muestra de reacción, ya que las reacciones son más lentas a menor temperatura; b) hacer que uno de los reactivos reaccione rápida, cuantitativamente y en forma irreversible con una sustancia determinada (scavenger). Sabiendo la estequiometría de esta reacción y analizando el producto entre el reactivo y el scavenger se podrá deducir la concentración del reactivo; c) diluir súbitamente la muestra en el solvente usado, ya que la velocidad de reacción disminuye al disminuir la concentración de los reactivos.
La mezcla reaccionante debe permanecer en un baño termostatado, ya que la constante de velocidad es función de la temperatura. Las curvas típicas que se obtienen para la reacción A P son de la forma:
La velocidad de reacción generalmente se define como la derivada de la concentración molar con respecto al tiempo. Para el reactivo A se define su velocidad de descomposición o desaparición como vA = -dCA/dt, donde C es concentración molar. Nótese que la derivada de A es negativa pero su velocidad de desaparición es positiva. La velocidad de aparición del producto P se define como vP = dCP/dt, donde tanto la derivada como la velocidad son positivas.
Leyes o ecuaciones de velocidad
Integración de Ecuaciones Cinéticas
Consideremos la reacción:
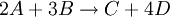 .
.La velocidad de esta reacción se puede expresar como:
-
-
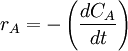 ó bien,
ó bien, 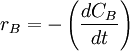 ó bien,
ó bien, 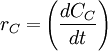 ó,
ó, 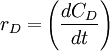
-
Estas cuatro velocidades son distintas, pero hay una relación entre ellas ya que:
Para tener una sola velocidad de reacción, ésta se define como la velocidad de cada especie dividida por su coeficiente estequiométrico. Veamos:
Categorías: Wikipedia:Fusionar | Cinética química -
Wikimedia foundation. 2010.