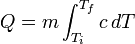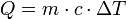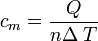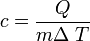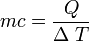- Calor
-
Calor
El calor es la transferencia de energía térmica desde un sistema a otro de menor temperatura. La energía térmica puede ser generada por reacciones químicas (como en la combustión), reacciones nucleares (como en la fusión nuclear de los átomos de hidrógeno que tienen lugar en el interior del Sol), disipación electromagnética (como en los hornos de microondas) o por disipación mecánica (fricción). Su concepto está ligado al Principio Cero de la Termodinámica, según el cual dos cuerpos en contacto intercambian energía hasta que su temperatura se equilibre.
El calor siempre se transfiere entre diferentes cuerpos o diferentes zonas de un mismo cuerpo que se encuentran a diferentes temperaturas y el flujo de calor siempre ocurre desde el cuerpo de mayor temperatura hacia el cuerpo de menor temperatura, ocurriendo la transferencia de calor hasta que ambos cuerpos se encuentren en equilibrio térmico.
El calor puede ser transferido por diferentes mecanismos, entre los que cabe reseñar la radiación, la conducción y la convección, aunque en la mayoría de los procesos reales todos los mecanismos anteriores se encuentran presentes en mayor o menor grado.
El calor que puede intercambiar un cuerpo con su entorno depende del tipo de transformación que se efectúe sobre ese cuerpo y por tanto depende del camino. Los cuerpos no tienen calor, sino energía interna. El calor es la transferencia de parte de dicha energía interna (energía térmica) de un sistema a otro, con la condición de que estén a diferente temperatura.
Contenido
Historia
Hasta el siglo XIX se explicaba el efecto del calor en la variación de la temperatura de un cuerpo por medio de un fluido invisible llamado calórico. Este se producía cuando algo se quemaba y, además, que podía pasar de un cuerpo a otro. La teoría del calórico afirmaba que una sustancia con mayor temperatura que otra, necesariamente, poseía mayor cantidad de calórico.
Benjamin Thompson y James Prescott Joule establecieron que el trabajo podía convertirse en calor o en un incremento de la energía térmica determinando que, simplemente, era otra forma de la energía.
Unidades de medida
La unidad de medida del calor en el Sistema Internacional de Unidades es la misma que la de la energía y el trabajo: el Joule (unidad de medida) Joule.
Otra unidad ampliamente utilizada para la cantidad de energía térmica intercambiada es la caloría (cal), que es la cantidad de energía que hay que suministrar a un gramo de agua a 1 atmósfera de presión para elevar su temperatura de 14,5 a 15,5 grados celsius. La caloría también es conocida como caloría pequeña, en comparación con la kilocaloría (kcal), que se conoce como caloría grande y es utilizada en nutrición.
1 kcal = 1000 cal Joule, tras múltiples experimentaciones en las que el movimiento de unas palas, impulsadas por un juego de pesas, se movían en el interior de un recipiente con agua, estableció el equivalente mecánico del calor, determinando el incremento de temperatura que se producía en el fluido como consecuencia de los rozamientos producidos por la agitación de las palas:
1 cal = 4,184 J El joule (J) es la unidad de energía en el Sistema Internacional de Unidades, (S.I.).
El BTU, (o unidad térmica británica) es una medida para el calor muy usada en Estados Unidos y en muchos otros países de América. Se define como la cantidad de calor que se debe agregar a una libra de agua para aumentar su temperatura en un grado Fahrenheit, y equivale a 252 calorías.
Calor específico
El calor específico es la energía necesaria para elevar 1 ºC la temperatura de una masa determinada de una sustancia. El concepto de capacidad calorífica es análogo al anterior pero para una masa de un mol de sustancia (en este caso es necesario conocer la estructura química de la misma).
El calor específico es un parámetro que depende del material y relaciona el calor que se proporciona a una masa determinada de una sustancia con el incremento de temperatura:
donde:
- Q es el calor aportado al sistema
- m es la masa del sistema
- c es el calor específico del sistema
- ΔT es el incremento de temperatura que experimenta el sistema
Las unidades más habituales de calor específico son:
- [c] =
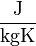
- [c] =
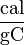
El calor específico de un material depende de su temperatura; no obstante, en muchos procesos termodinámicos su variación es tan pequeña que puede considerarse que el calor específico es constante. Asimismo, también se diferencia del proceso que se lleve a cabo, distinguiéndose especialmente el "calor específico a presión constante" (en un proceso isobaro) y "calor específico a volumen constante (en un proceso isocoro).
De esta forma, y recordando la definición de caloría, se tiene que el calor específico del agua es aproximadamente:
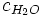 = 1,000
= 1,000 ![\left [ \frac{cal}{gC} \right ]](/pictures/eswiki/98/b0a486e5343f3d6352197961fb6f6149.png)
Calor específico molar
El calor específico de una sustancia es un índice importante de su constitución molecular interna, y a menudo da información valiosa de los detalles de su ordenación molecular y de las fuerzas intermoleculares. En este sentido, con frecuencia es muy útil hablar de calor específico molar denotado por cm, y definido como la cantidad de energía necesaria para elevar la temperatura de un mol de una sustancia en 1 grado es decir, está definida por:
donde n indica el la cantidad de moles en la sustancia presente.
Capacidad calorífica
La capacidad calorífica de una sustancia es una magnitud que indica la mayor o menor dificultad que presenta dicha sustancia para experimentar cambios de temperatura bajo el suministro de calor. Se denota por C y se define como:
- C =
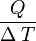
![\left [ \frac{J}{K} \right ]](/pictures/eswiki/50/28a965e43a814809c9426baece39a88c.png)
Dado que:
 C = mc
C = mcDe igual forma se puede definir la capacidad calórica molar como:
- Cn = nc
Cambios de fase
En la naturaleza existen tres estados usuales de la materia : sólido, líquido y gaseoso. Al aplicarle calor a una sustancia, ésta puede cambiar de un estado a otro. A estos procesos se les conoce como Cambios de Fase. Los posibles cambios de fase son:
-
- de estado sólido a líquido, llamado fusión,
- de estado líquido a sólido, llamado solidificación,
- de estado líquido a gaseoso, llamado evaporación o vaporización,
- de estado gaseoso a líquido, llamado condensación,
- de estado sólido a gaseoso, llamado sublimación progresiva,
- de estado gaseoso a sólido, llamado sublimación regresiva o deposición,
- de estado gaseoso a plasma, llamado ionización.
Calor latente
Un cuerpo sólido puede estar en equilibrio térmico con un líquido o un gas a cualquier temperatura, o que un líquido y un gas pueden estar en equilibrio térmico entre sí, en una amplia gama de temperaturas, ya que se trata de sustancias diferentes. Pero lo que es menos evidente es que dos fases o estados de agregación , distintas de una misma sustancia, puedan estar en equilibrio térmico entre sí en circunstancias apropiadas.
Un sistema que consiste en formas sólida y líquida de determinada sustancia, a una presión constante dada, puede estar en equilibrio térmico, pero únicamente a una temperatura llamada punto de fusión simbolizado a veces como tf. A esta temperatura, se necesita cierta cantidad de calor para poder fundir cierta cantidad del material sólido, pero sin que haya un cambio significativo en su temperatura. A esta cantidad de energía se le llama calor de fusión, calor latente de fusión o entalpía de fusión, y varía según las diferentes sustancias. Se denota por Lf. El calor de fusión representa la energía necesaria para deshacer la fase sólida que está estrechamente unida y convertirla en líquido. Para convertir líquido en sólido se necesita la misma cantidad de energía, por ellos el calor de fusión representa la energía necesaria para cambiar del estado sólido a líquido, y también para pasar del estado líquido a sólido. El calor de fusión se mide en:
- [Lf] =
![\left [ \frac{cal}{g} \right ]](/pictures/eswiki/54/6509967ee8eee2ff6aa885e24a16fafa.png)
De manera similar, un líquido y un vapor de una misma sustancia pueden estar en equilibrio térmico a una temperatura llamada punto de ebullición simbolizado por te. El calor necesario para evaporar una sustancia en estado líquido ( o condensar una sustancia en estado de vapor ) se llama calor de ebullición o calor latente de ebullición o entalpía de ebullición, y se mide en las mismas unidades que el calor latente de fusión. Se denota por Le.
En la siguiente tabla se muestran algunos valores de los puntos de fusión y ebullición y entalpías de algunas sustancias:
sustancias tf [°C] Lf [cal/g] te [°C] Le [cal/g] H20 0,00 79,71 100,00 539,60 O2 -219,00 3,30 -182,90 50,90 Hg -39,00 2,82 357,00 65,00 Cu 1083,00 42,00 2566,90 Transmisión de calor
El calor puede ser transmitido de tres formas distintas: por conducción, por convección o por radiación.
- Conducción térmica: es el proceso que se produce por contacto térmico entre dos cuerpos, debido al contacto directo entre las partículas individuales de los cuerpos que están a diferentes temperaturas, lo que produce que las partículas lleguen al equilibrio térmico. Ej: cuchara metálica en la taza de té.
- Convección térmica: sólo se produce en fluidos (líquidos o gases), ya que implica movimiento de volúmenes de fluido de regiones que están a una temperatura, a regiones que están a otra temperatura. El transporte de calor está inseparablemente ligado al movimiento del propio medio. Ej.: los calefactores dentro de la casa.
- Radiación térmica: es el proceso por el cual se transmite a través de ondas electromagnéticas. Implica doble transformación de la energía para llegar al cuerpo al que se va a propagar: primero de energía térmica a radiante y luego viceversa. Ej.: La energía solar.
La conducción pura se presenta sólo en materiales sólidos.
La convección siempre está acompañada de la conducción, debido al contacto directo entre partículas de distinta temperatura en un líquido o gas en movimiento.
En el caso de la conducción, la temperatura de calentamiento depende del tipo de material, de la sección del cuerpo y del largo del cuerpo. Esto explica porqué algunos cuerpos se calientan más rápido que otros a pesar de tener exactamente la misma forma, y que se les entregue la misma cantidad de calor.
- Conductividad térmica
La conductividad térmica de un cuerpo está dada por:
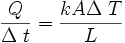 ;
;
donde:
- Q es el calor entregado,
- Δt es el intervalo de tiempo durante el cual se entregó calor,
- A es la sección del cuerpo,
- L es la longitud, y
- ΔT es el incremento en la temperatura.
Medida experimental del calor
Para determinar, de manera directa, el calor que se pone de manifiesto en un proceso de laboratorio, se suele emplear un calorímetro. En esencia, se trata de un recipiente que contiene el líquido en el que se va a estudiar la variación de energía por transferencia de calor y cuyas paredes y tapa (supuestamente adiabáticas) deben aislarlo, al máximo, del exterior.
Un termo de paredes dobles de vidrio, cuyas superficies han sido previamente metalizadas por deposición y que presenta un espacio vacío entre ellas es, en principio, un calorímetro aceptable para una medida aproximada de la transferencia de calor que se manifiesta en una transformación tan sencilla como esta. El termo se llama vaso Dewar y lleva el nombre del físico y químico escocés James Dewar pionero en el estudio de las bajas temperaturas. En la tapa aislante suele haber un par de orificios para introducir un termómetro, con el que se evaluaría el incremento (o decremento) de la temperatura interior del líquido, y un agitador para tratar de alcanzar el equilibrio térmico en su interior, lo más rápido posible, usando un sencillo mecanismo de convección forzada.
No sólo el líquido contenido en el calorímetro absorbe calor, también lo absorbe las paredes del calorímetro. Lo mismo sucede cuando pierde calor. Esta intervención del calorímetro en el proceso se representa por su equivalente en agua. La presencia de esas paredes, no ideales, equivale a añadir al líquido que contiene, los gramos de agua que asignamos a la influencia del calorímetro y que llamamos "equivalente en agua". El "equivalente en agua" viene a ser "la cantidad de agua que absorbe o desprende el mismo calor que el calorímetro".
Véase también
- Calorimetría
- Temperatura
- Termodinámica
- Conducción de calor
- Bolsa de agua caliente
- Teoría calórica
- Teoría cinética de los gases ideales (Continuación del estudio de Calor y temperatura).
- Introducción a la mecánica de fluidos
Enlaces externos
Categoría: Termodinámica
Wikimedia foundation. 2010.