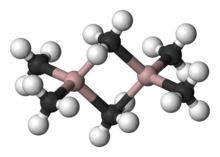
- Compuesto de organoaluminio
-
Un compuesto de organoaluminio es un compuesto químico que contiene algún enlace covalente entre átomos de carbono y de aluminio. Su estudio se realiza dentro de la química organometálica.[1] [2] Un ejemplo de este tipo de compuestos es el dímero trimetilaluminio, el monómero triisobutilaluminio y el compuesto de titanio-aluminio llamado reactivo de Tebbe. El comportamiento de los compuestos de organoaluminio puede ser entendido en términos de la polaridad del enlace C-Al y la alta acidez de Lewis de las tres especies coordinadas. A nivel industrial, estos compuestos se utilizan principalmente para la producción de poliolefinas.
Contenido
Historia
El primer compuesto de organoaluminio (C2H5)3Al2I3 fue descubierto en 1859.[3] Los compuestos de organoaluminio fueron sin embargo poco conocidos hasta la década de 1950 cuando Karl Ziegler y sus colegas descubrieron la síntesis directa de compuestos de trialquilaluminio y aplicaron estos compuestos a la polimerización de olefinas con catalizadores. Esta línea de investigación, en última instancia, dio lugar a la concesión a Ziegler del Premio Nobel.
Estructura y enlace
Compuestos de aluminio (III)
Los compuestos de organoaluminio generalmente cuentan con centros de aluminio con coordinación tres y cuatro, aunque números de coordinación superiores se han observado con ligandos inorgánicos, tales como fluoruros. De acuerdo con las tendencias habituales, el átomo de Al con coordinación cuatro prefiere adoptar una estructura tetraédrica. En contraste con el boro, el aluminio es un átomo más grande y se adapta fácilmente a la coordinación con cuatro ligandos de carbono. Los compuestos de triorganoaluminio son por lo tanto generalmente dímeros con un par de ligandos alquilo actuando como ligandos puente, por ejemplo, Al2(C2H5)4(μ-C2H52. Por lo tanto, a pesar de su nombre común de trietilaluminio, este compuesto contiene dos centros de aluminio, y seis grupos etilo. Cuando el compuesto de organoaluminio contiene hidruro o haluro, estos ligandos más pequeños tienden a ocupar los lugares de transición. La coordinación 3 se produce cuando los grupos R son, por ejemplo, voluminosos, como el Al(Mes)3 (donde Mes = 2,4,6-Me3C6H2 es el grupo mesitilo) o isobutilo.[4]
Intercambio de ligandos en compuestos de trialquilaluminio
Los dímeros trialquilaluminio a menudo participan de un equilibrio dinámico, que resulta en el intercambio de los ligandos puente y terminal, así como en el intercambio de ligandos entre los dímeros. Incluso en disolventes no cordinantes, el cambio Al-Me es rápido, según lo confirmado por espectroscopia RMN de protón. Por ejemplo, a -25 °C, el espectro RMN de 1H en Me6Al2 se compone de dos señales en relación 1:2, como se esperaba de la estructura en estado sólido. A 20 °C, sólo se observa una señal ya que el intercambio de los grupos metilo terminal y puente es demasiado rápido para ser resuelto por RMN. La alta acidez de Lewis de las especies monoméricas se relaciona con el tamaño del centro Al(III) y su tendencia a alcanzar un octeto de electrones en la última capa.
Compuestos de organoaluminio de menor valencia
En 1988 se informó la existencia del primer compuesto de organoaluminio con un enlace Al-Al (((Me3Si)2CH)2Al)2 (un dialano). Por lo general son preparados por reducción de cloruros de dialquillaluminio con potasio metálico:[5]
- (R2AlCl)2 + 2 K → R2Al-AlR2 + 2 KCl
Otro grupo notable de alanos son los tetraalanos que contienen centros Al(I). Estos compuestos adoptan una tetrahedrano central, como se ilustra en (Cp*Al)4 y ((Me3Si3C)Al)4. El clúster [Al12(i-Bu)12]2- se obtuvo en investigaciones relacionadas con la reducción de compuestos de organoaluminio. Este dianión adopta una estructura icosaédrica que recuerda la del dodecaborato ([B12H12]2-). Su estado de oxidación formal es menor de uno.
Preparación
A partir de haluros de alquilo y aluminio
Industrialmente, los alquilos simples de aluminio del tipo Al2R6 (R = Me, Et) se preparan en un proceso en dos fases que comienza con la alquilación de polvo de aluminio:
- 2 Al + 3 CH3CH2Cl → (CH3CH2)3Al2Cl3
La reacción se asemeja a la síntesis de los reactivos de Grignard. El producto, (CH3CH2)3Al2Cl3, se llama sesquicloruro de etilaluminio. El término sesquicloruro se refiere al hecho de que, en promedio, la relación Cl:Al es de 1,5. Estos sesquicloruros se pueden convertir en derivados de de triorganoaluminio por reducción::2 (CH3CH2)3Al2Cl3 + 6 Na → (CH3CH2)6Al2 + 2 Al + 6 NaCl Este método se utiliza para la producción de trimetil y trietilaluminio.[6]
Hidroaluminación
El polvo de aluminio reacciona directamente con algunos alquenos terminales, en presencia de hidrógeno. El proceso conlleva dos fases, en la primera de las cuales se producen hidruros de dialquilaluminio. Estas reacciones por lo general se realizan a temperaturas elevadas y requieren la activación por reactivos de trialquilaluminio:
- 3 Al + 3/2 H2 + 6 CH2=CHR → [HAl(CH2CHR)2]3
Para grupos sustituyentes R no voluminosos, los hidruros de organoaluminio suelen trímeros. En una etapa posterior, estos hidruros son tratados con más alqueno para conseguir la hidroalumiunación:
- 2 [HAl(CH2CHR)2]3 + 3 CH2=CHR → 3 [Al2(CH2CHR)3
El hidruro de diisobutilaluminio, que es dímero, se prepara por eliminación a partir de hidruro de triisobutilaluminio:
- 2 i-Bu3Al → (i-Bu2AlH)2 + 2 editar] Síntesis de laboratorio
Aunque algunos compuestos simples de este grupo están comercialmente disponibles a bajo costo, se han desarrollado muchos métodos para su síntesis en el laboratorio, incluyendo reacciones de metátesis o de transmetalación. La metátesis de tricloruro de aluminio con RLi o RMgX da como producto el trialquilaluminio:
- AlCl3 + 3 BuLi → Bu3Al + 3 LiCl
- Transmetalación
- 2 Al + 3 HgPh2 → 2 AlPh3 + 3 Hg
Reacciones
Acidez de Lewis
Los compuestos de organoaluminio son ácidos fuertes y forman aductos fácilmente con bases tales como piridina, THF y aminas terciarias. En estos aductos, el átomo de Al es tetraédrico.
Electrófilos
El enlace Al-C está polarizado porque el carbono es muy básico. Con los ácidos reaccionan para dar alcanos. Por ejemplo, con los alcoholes dan alcóxidos:
- AlR'3 + ROH → (R'2Al−OR)n + R'H
Se pueden emplear una amplia variedad de ácidos además de los ácidos minerales más simples. Con las aminas dan derivados amida. Con dióxido de carbono, los compuestos de trialquilaluminio dan carboxilato de dialquilaluminio:
- AlR3 + CO2 → R2AlO2CR
La conversión es una reminiscencia de la carbonatación del reactivo de Grignard.
Con oxígeno se obtiene el correspondiente alcóxido, el cual puede ser hidrolizado para dar un alcohol:
- AlR3 + 3/2 O2 → Al(OR)3
Polimerización de alquenos
Industrialmente, los compuestos de organoaluminio pueden ser utilizados como catalizadores para la polimerización de alquenos dando poliolefinas, por ejemplo, el catalizador metilaluminoxano.
Véase también
Compuestos de carbono con otros elementos de la tabla periódica
Enlaces químicos del carbono con el resto de átomos
CH He CLi CBe CB CC CN CO CF Ne CNa CMg CAl CSi CP CS CCl CAr CK CCa CSc CTi CV CCr CMn CFe CCo CNi CCu CZn CGa CGe CAs CSe CBr CKr CRb CSr CY CZr CNb CMo CTc CRu CRh CPd CAg CCd CIn CSn CSb CTe CI CXe CCs CBa CHf CTa CW CRe COs CIr CPt CAu CHg CTl CPb CBi CPo CAt Rn Fr Ra Rf Db Sg Bh Hs Mt Ds Rg Uub Uut Uuq Uup Uuh Uus Uuo ↓ La CCe Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm CYb Lu Ac Th Pa CU Np Pu Am Cm Bk Cf Es Fm Md No Lr Enlaces químicos con carbono: Importancia relativa Química orgánica básica. Muchos usos en Química. Investigación académica,
pero no un amplio uso.Enlace desconocido /
no evaluado.Referencias
- ↑ Atkins inorganic chemistry, organometallic compounds.
- ↑ Organoaluminum chemistry at the forefront of research and development M. Witt and H. W. Roesky CURRENT SCIENCE, VOL. 78, NO. 4, 25 FEBRERO 2000
- ↑ Hallwachs, W. and Schafarik, A., "Ueber die Verbindungen der Erdmetalle mit organischen Radicalen" Liebigs Ann. Chem., 1859, 109, 206-209.doi 10.1002/jlac.18591090214
- ↑ Elschenbroich, C. ”Organometallics” (2006) Wiley-VCH: Weinheim. ISBN 978-3-29390-6
- ↑ Uhl, Werner "Organoelement Compounds Possessing Al---Al, Ga---Ga, In---In, and Tl---Tl Single Bonds" Advances in Organometallic Chemistry Volume 51, 2004, Pages 53-108. doi 10.1016/S0065-3055(03)51002-4
- ↑ Michael J. Krause, Frank Orlandi, Alfred T. Saurage and Joseph R. Zietz "Aluminum Compounds, Organic" in Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. doi 10.1002/14356007.a01_543
Categorías:- Compuestos de aluminio
- Compuestos organometálicos
Wikimedia foundation. 2010.